原子には複数の電子が含まれます。
電子は、内側のここらへんに2つ、次ここらへんに8つ、、、という感じで、電子いくつかをグループとして、配置に関して規則性が見られます。
具体的には
原子核を中心として、同心円を考えます。一番内側を K 殻と呼びます。K 殻には電子が2つ配置されます。例えば 水素原子 H は電子が1つですが、この電子は K 殻に配置されます。K 殻のどこかに1つ電子が存在する ということです。He であれば、電子2個です。2個の電子は 共に K 殻 に配置されます。
内側から n 番目の殻に入ることができる電子数は 2n2 です。K 殻は最も内側なので、2 × 12 = 2 個までしか電子は入りません。ある殻の電子が満杯になることを「閉殻」と呼びます。閉殻状態は安定です。そのため、水素原子よりも He 原子の方が安定です。
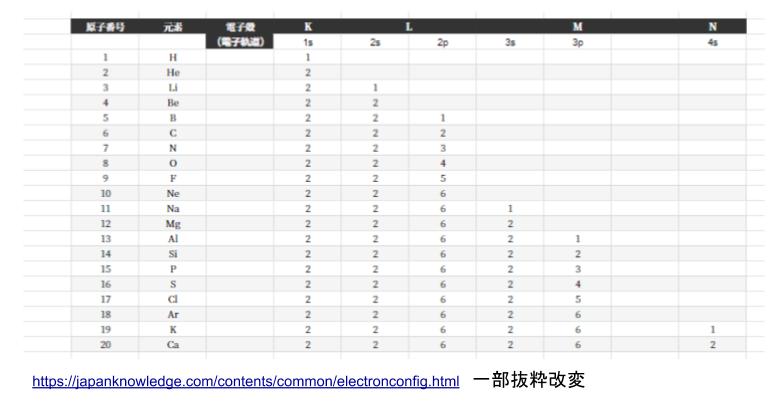
電子が入っている一番外側の殻を「最外殻」と呼びます。最外殻電子は8個までというルールがあります。原子番号1~20までの電子配置について表でまとめたものが以下になります。L殻は 2s,2p 軌道というように、殻はさらにいくつかの軌道に分類されます。

コメント