問 題
含窒素複素環化合物に関する記述のうち、正しいのはどれか。2つ選べ。
- 水溶性は、ピリジンよりキノリンの方が高い。
- 塩基性は、ピロリジンよりピロールの方が弱い。
- 重クロロホルム中で測定した1H-NMRのうち、炭素原子に結合した水素のシグナルは、ピリジンよりピペリジンの方が高磁場に観測される。
- 芳香族求電子置換反応は、ピロールよりピリジンの方が速い。
解 説
この問題では多くの含窒素化合物が出てきます。これらの構造は紛らわしいのですが、どれも大事な化合物ですので、その構造を正確に覚えておく必要があります。
まず、選択肢 1 のピリジンとキノリンの構造を見てください。
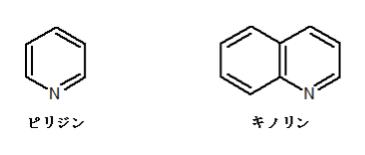
構造を見るとピリジンには3つの二重結合があり、つまり6つのπ電子を持っています。キノリンには 5 つの二重結合、つまり 10 のπ電子を持っています。これはともにHückel則(π電子が4n+2個)を満たしているため、ピリジンもキノリンも芳香族性を有しています。
芳香族化合物は概して有機溶媒に溶けやすいのですが、ここでは水溶性の大小が問われています。キノリンはピリジンに比べて分子量が大きい上、水に溶けにくいベンゼン環が追加された構造をしているので、より水に溶けにくくなります。
選択肢 2 のピロリジンとピロールの構造は以下のとおりです。
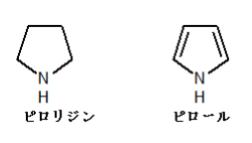
上図のとおり、ピロリジンは N 原子上に非共有電子対を持っているため、塩基性を示します。
一方、ピロールは 2 つの二重結合と、N 原子上の非共有電子対の計6つのπ電子により芳香族性を保っています。仮にピロールが塩基として働くと、この非共有電子対を失うことになり、芳香族性が崩れてしまいます。よって、実際にはピロールの塩基性は弱く、この選択肢 2 は正解です。
選択肢 3 のピリジン、ピペリジンは次のような構造をしています。
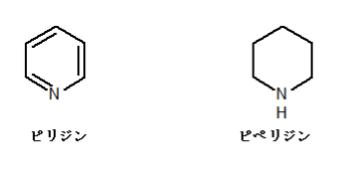
ピリジンは芳香族化合物であり、ピペリジンは違います。芳香環を成す炭素に結合している水素の 1H-NMR のシグナルは、7~9 ppm前後に現れます。よってピリジンではかなり低磁場側(数字が大きいほど低磁場です)にシグナルが見られます。一方のピペリジンもN原子の隣の炭素に結合した水素はやや低磁場側にシフトしますが、それでも3 ppm程度です。それ以外の水素に関しては 1~2 ppm前後となるため、選択肢 3 も正しい内容です。
選択肢 4 について、ピロールとピリジンの構造は上記のとおりです。
どちらも芳香族化合物ですが、最大の違いはN原子上の非共有電子対がπ電子系に含まれるか否かです。ピロールは非共有電子対を合わせて6π電子であり、ピペリジンは二重結合だけで6π電子になっています。その違いにより、両化合物の共鳴構造は以下のように異なってきます。
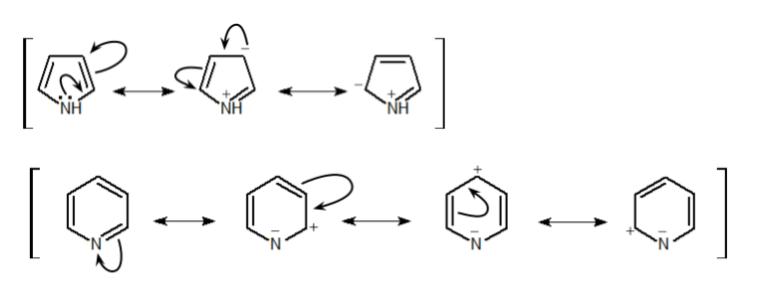
ピロールの場合、上図上側のように非共有電子対が炭素側にも流れてゆき、炭素側の電子密度が高くなります。その結果、電子豊富となるため、求電子置換反応も起こりやすくなります。
一方、ピリジンの場合、非共有電子対は共鳴には寄与しません。上図下側のように、むしろ炭素側の電子を引き寄せて、炭素側の電子密度が低くなっています。結果として、炭素側の電子が不足している状態なので求電子置換反応は起こりづらくなります。よって、選択肢 4 はその記述が逆なので、誤りです。
以上より、正解は選択肢 2, 3 となります。

コメント