問 題
炭酸ナトリウム水溶液の pH の求め方に関する次の記述の ㋐,㋑ に当てはまるものの組合せとして最も妥当なのはどれか。ただし,25 ℃ における,炭酸の第一解離定数 Ka1 は 4.3 × 10-7 mol・L-1,第二解離定数 Ka2 は 4.8 × 10-11 mol・L-1 とし,化学種 X のモル濃度を [X] と表す。「炭酸ナトリウムの水溶液中の平衡を
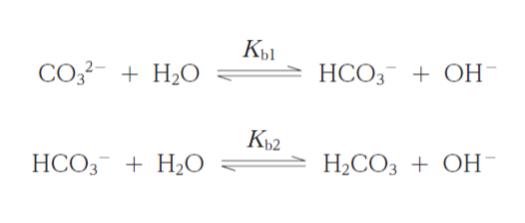
で表したとき,Ka1,Ka2,Kb1,Kb2 の間には
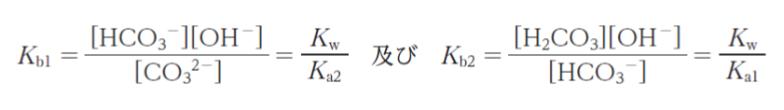
の関係がある。ここで、Kw は水のイオン積である。また,物質収支を考慮すると炭酸ナトリウムのモル濃度は㋐で表される。
炭酸ナトリウム水溶液の pH は,Kb1 と Kb2 の値の間に十分大きな差があることから第二段階以下の電離による [OH–] を無視し,さらに,水の電離による [OH–] を無視することで近似的に求まる。25 ℃ における 0.10 mol・L-1 の炭酸ナトリウム水溶液の pH はおよそ ㋑ となる。

解 説
炭酸ナトリウム Na2CO3 は、水中で完全に電離して 2 Na+ + CO32- となります。そして、水溶液中で問題文に与えられているように、CO32-、HCO3–、H2CO3 のどれかとして存在しています。これらの物質は炭酸ナトリウム由来なので、全部足せば炭酸ナトリウムのモル濃度です。従って、㋐ は [CO32-] + [HCO3–] + [H2CO3] です。正解は 3 or 4 です。
㋑ ですが
「第二段階以下の電離に…を無視し」という点をふまえて、第一段階の電離のみに注目します。初めに 炭酸ナトリウム Na2CO3 0.1mol/L を入れているので、全体を 1L と設定すればより具体的で考えやすいです。CO32- が初めは 0.1mol となります。平衡時を考えると、以下のようにまとめることができます。
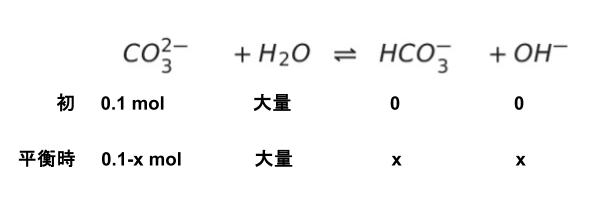
問題文の Kb1 の関係式に、上の平衡時における物質量を代入します。また、Kw = 1.0 × 10-14 は基礎知識として、知っている前提と思われます。
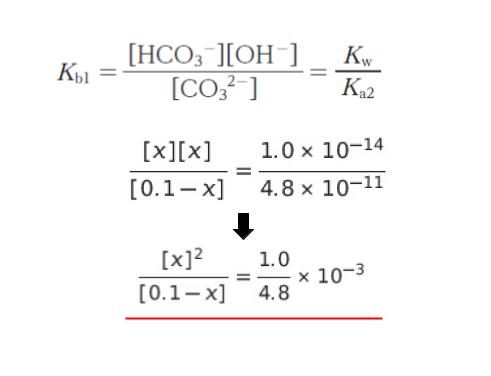
この等式から x を求めることができるのですが、試験では選択肢の判断ができればよいです。
選択肢 3 が正解と仮定します。
pH = 10.3 であれば、pOH = 14 – 10.3 = 3.7 です。すると、x = [OH–] = 10-3.7 です。
10-3.7 ≒ 10-4 として考えます。この時、0.1 – x は 0.1 – 0.0001 なので、近似して 0.1 でよいとします。すると、式の左辺: [10-4]2/0.1 = 10-7 となります。明らかに右辺と桁が違うため、誤りです。
以上より、正解は 4 です。
類題 H29no20 硫酸の二段階乖離
https://yaku-tik.com/yakugaku/km-29-20/

コメント