前項までで求核置換反応と脱離反応の説明をしてきましたが、どちらの反応でも求核試薬を用いていました。この項では、その求核試薬の強さについて解説します。
求核試薬の強さは、基本的には塩基性の強さと同じと考えて問題ありません。塩基性が強ければそれだけ求核性が上がり、ひいては反応性が上がるといえます(例外もあります)。
以下に、求核試薬の強弱の具体的な比較について記述していきます。
イオン形と分子形
2 つの求核試薬の一方が陰イオンで他方が分子形である場合、イオンのほうが塩基性が高く、求核性も高いです。
求核試薬は「核を求める」、つまり「正電荷を攻撃する」試薬であるため、自身は負電荷を帯びているほうが良いというのは納得しやすいと思います。
例えば CH3O- と CH3OH はどちらも求核試薬にはなりますが、前者のほうが強い求核試薬となります。NH2‐ と NH3 も同じく、イオン形である前者のほうが強い求核試薬です。
CH3O‐、C6H5O‐、CH3COO‐ は全てイオン形ですが、これらの塩基性の強さは
- CH3O‐ > C6H5O‐ > CH3COO‐
になるため、求核試薬の強さもこの順番となります。これらの序列を考えるときは、その共役酸について考えてください。
共役酸はそれぞれ CH3OH (メタノール)、C6H5OH (フェノール)、CH3COOH (酢酸)であり、その酸性の強さは次のようになります。
- CH3COOH > C6H5OH > CH3OH
塩基性の強さの順番と共役酸の酸性の強さの順番は逆になることを覚えておけば、先ほどの順番が導けると思います(これは塩基とその共役酸だけでなく、酸とその共役塩基でも同じことがいえます)。
同周期での比較
同じ周期にある元素で比較した場合、左側にある元素を含む求核試薬のほうが求核性が高くなります。
周期表の左側が塩基性寄りで、右側が酸性寄りであることから考えると、これも求核性の強さと塩基性の強さが一致しています。
- NH2‐ > OH‐ > F‐
同族での比較
同じ族の元素で求核性の大小を比較する場合は、その反応溶媒がプロトン性溶媒(水)であるか、非プロトン性極性溶媒であるかによって大小関係が変わってきます。
わかりやすいのは非プロトン性極性溶媒のときで、この場合は、周期表の上の元素を含む求核試薬のほうが求核性が高くなります。つまり、今までの説明と同様に、塩基性が高いもののほうが求核性も高くなるということです。
- F‐ > Cl‐ > Br‐ > I‐
一方、プロトン性溶媒のときはその逆で、周期表の下の元素を含む求核試薬のほうが求核性が高くなります。これでは求核性の高さと塩基性の強さの相関関係が合いませんが、その原因は水素結合にあります。
たとえばフッ素は電気陰性度が高い上に原子半径が小さいので、水素と強く結びついています(水素結合)。溶媒中のプロトンとの結びつきが強いが故に、他の分子との反応性は低くなるので、求核性は低いといえます。
この特徴はプロトンがあって初めて生じるものなので、プロトン性溶媒のとき限定の話である点に注意してください。
- I‐ > Br‐ > Cl‐ > F‐
立体障害
立体障害が大きい求核試薬は、基質に攻撃しようとする際に近づきづらいため、その求核性が低いといえます。一方、立体障害の少ない求核試薬は、基質に攻撃をしやすいので、求核性が高くなります。
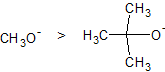

コメント