問 題
図は、3種類の電解質(NaOH,CH3COOH,NaCl)溶液のモル伝導率(Λ)と濃度(c)の平方根との関係を示している。図中のa~cと電解質の正しい組合せはどれか。1つ選べ。
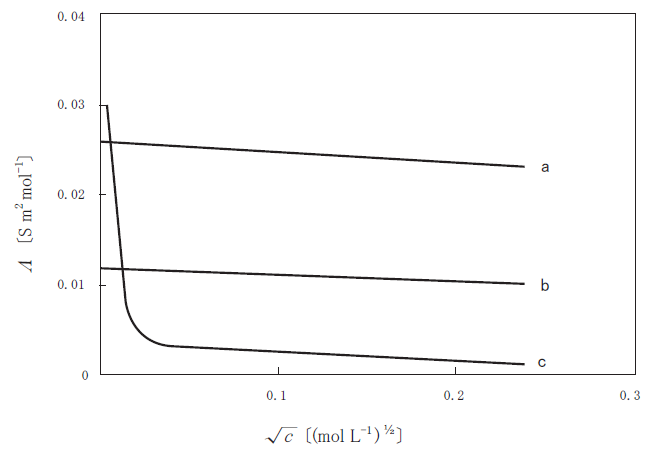
- a b c
- NaOH CH3COOH NaCl
- NaOH NaCl CH3COOH
- CH3COOH NaOH NaCl
- CH3COOH NaCl NaOH
- NaCl CH3COOH NaOH
- NaCl NaOH CH3COOH
解 説
強電解質では、縦軸にΛ、横軸に √C をとると直線減少になることが知られています。これは、コールラウシュの法則と呼ばれます。
3 種類の電解質のうち、強電解質(つまり電離度が1に近い。)のは、NaOH、NaCl です。弱電解質(つまり、電離度が小さい)のは、CH3COOH です。よって、直線関係になっている、a,b はそれぞれ NaOH か NaCl であり、曲線関係になっている、c は、CH3COOH です。
又、このグラフの y 切片は、c が限りなく 0 に近づいた状態、すなわち無限希釈状態におけるモル伝導率です。これは極限モル伝導率(Λ∞)と呼ばれ、電解質に固有の値です。
そして、Λ∞ は、陽イオン、陰イオンそれぞれの極限モル伝導率の和で表されます。NaOH と、NaCl は、電離した時の陽イオンは同じであるため、陰イオンの極限モル伝導率によって y 切片が決まります。
本問では、代表的な陰イオンの極限モル伝導率の大雑把な順位を知っている もしくは 推測することが求められていると考えられます。OH- は、陰イオンの中で特に高い極限モル伝導率を持ちます。そのため、NaOH の方が、Λ∞ は高くなります。
以上より、正解は 2 です。
※ 推測する方法としては、陽イオンの極限モル伝導率についてよく知られている事実である
「H+ の極限モル伝導率が、陽イオンの中で特異的に高い」ことからの推測が有効かと思います。
すなわち、H+ がなぜイオン伝導率が高いのかといえば、H+ が周囲の水分子間を連鎖的に
とんでいくからと学ぶと思います。となれば、OH が周囲の水分子の一部として存在している環境において、OHー も、周囲の水分子間を、同様に連鎖的にとんでいくのではないかと推測することで正答を予測できるのではないかと考えられます。

コメント