問 題
ヒドロキシ基(OH基)を持つ3つの化合物について、酸性の強いものから弱いものへ並べた正しい順番はどれか。1つ選べ。
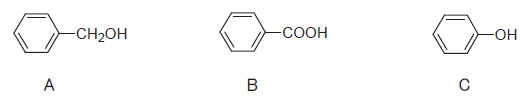
- A > B > C
- A > C > B
- B > A > C
- B > C > A
- C > A > B
- C > B > A
解 説
種々の酸を強い順に順番に並べると、スルホン酸(-SO3H) > カルボン酸(-COOH) > 炭酸(H2CO3 または CO2) > フェノール(C6H5OH) となります。よく語呂合わせとして「スカタンのフェノール」などと言われることがあります(ス→スルホン酸、カ→カルボン酸、タン→炭酸、フェノールはそのまま)。この語呂合わせにアルコールは登場しませんが、これはアルコールが酸性ではないためです。つまり、アルコールは中性の化合物です。
以上を知っていれば、この問題ではカルボン酸である B(安息香酸)が最も酸性が強く、次いでC(フェノール)、最も酸性の弱いものがアルコールの A(ベンジルアルコール)ということになります。よって、選択肢 4 が正解です。
もちろん、この序列を暗記していないとしても、この問題を解くことはできます。定義にもよりますが、一般的に、酸はプロトンを与える性質を持ちます。この性質が強ければ強い酸といえます。別の言い方をすれば、電離度の大きい酸は強い酸であるということです。ここで、例として問題にある化合物 A , B , C のそれぞれが電離した時の状態を考えてください。
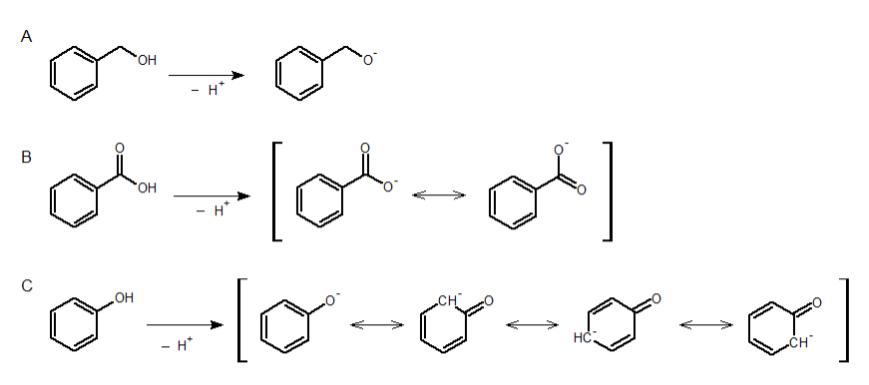
まず上図の A を見ると、プロトンを放出した形が特に共鳴構造を持つわけでも誘起効果があるわけでもないことがわかります。よって、このイオンはあまり安定とはいえず、Aのベンジルアルコールは電離しにくい(=酸性が弱い)化合物であると判断できます。
次に B と C を見ると、脱プロトン化体が共鳴安定化していることがわかります。よって、Aよりは強い酸であることがわかります。ここで、「BよりもCのほうが共鳴構造が多いから、より安定である。」と考えてしまうのは誤りです。
よく見ると、B のほうは電気陰性度が高い酸素原子が負電荷が持つ共鳴構造が2つあります。一方の C は、共鳴構造の数は多いものの、1つ以外は炭素原子上に負電荷があります。
炭素は酸素よりも電気陰性度が低いため、そこに負電荷があってもあまり安定ではありません。以上のことから、Bの安息香酸はCのフェノールよりも強い酸であるといえます。よって正解は選択肢 4 と判断できます。

コメント