問 題
アミノ酸は両性化合物であり、その等電点(pI)と電荷はイオン交換クロマトグラフィーや等電点電気泳動における分離挙動を決定する因子となる。下に3つのアミノ酸の構造式とpKa値を示す。
これらのアミノ酸の等電点と電荷に関する記述のうち、正しいのはどれか。2つ選べ。
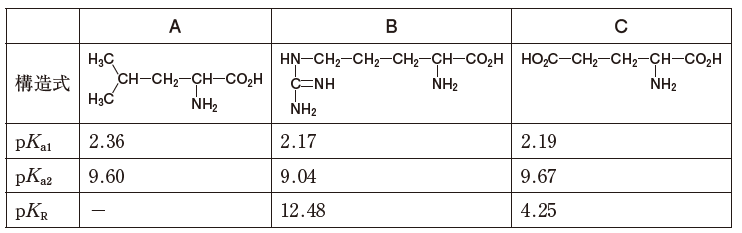
*pKa1はα炭素に結合しているカルボキシ基のpKa、pKa2はα炭素に結合しているアミノ基のpKa、pKRは側鎖部分のpKaである。
- アミノ酸AのpIは、約5.98である。
- アミノ酸BのpIは、約5.61である。
- アミノ酸Aは、pH2.33の緩衝液中では負電荷を持つ。
- アミノ酸Bは、pH5.61の緩衝液中では正電荷を持つ。
- アミノ酸Cは、pH3.22の緩衝液中では正電荷を持つ。
解 説
等電点とは、正の荷電と負の荷電が等しくなる pH のことです。原則、アミノ基 (-NH2) とカルボキシル基(-COOH) の酸解離定数 pKa の平均が等電点です。酸性アミノ酸のように、COOH が側鎖にもある場合は、等電点が酸性に寄ります。すなわち、等電点が小さくなります。塩基性アミノ酸のように、-NH2 が側鎖にもある場合は、等電点が塩基性に寄ります。
ちなみに、本問では必要ないのですが、生化学の基礎知識として、アミノ酸は構造から特定できる必要があります。A はロイシン、B はアルギニン、C はグルタミン酸です。
選択肢 1 は妥当です。
(2.36 + 9.60) ÷ 2 = 5.98 です。
選択肢 2 ですが
アミノ酸 B の pI は、(2.17+9.04) ÷ 2 ≒ 5.61 よりも塩基性に寄ります。従って誤りです。
選択肢 3 ですが
pH 2.33 であれば、アミノ基 が ーNH3+ となっており、カルボキシル基は ーCOOH のままである「陽イオン型」が大部分と考えられます。その場合持っているのは「正電荷」です。負電荷ではありません。選択肢 3 は誤りです。
選択肢 4 は妥当です。
等電点が塩基よりなので、それよりも pH が小さい領域、すなわち酸性領域においては、陽イオン型の方が多く、正電荷を有すると考えられます。
選択肢 5 ですが
pH が大きくなるにつれて、陽イオン型(+1)→双生イオン型1(±0)→双生イオン型2(-1)→陰イオン型(-2)と割合が多くなります。pH 3.22 は、2.19 と 4.25 の真ん中です。ちょうど 双生イオン型1が一番多く、かつ、陽イオン型と双生イオン型2が半々ぐらいになっている、等電点付近と思われます。正電荷を持つ とはいえません。選択肢 5 は誤りです。
以上より、正解は 1,4 です。

コメント