問 題
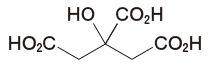
前問で調製した1mol/L水酸化ナトリウム液を標定した結果、ファクターは、1.025であった。日本薬局方無水クエン酸(C6H8O7:192.12、下図)適量を水50mLに溶かし、この標準液を用いて滴定した結果、滴定量は7.85mLであった(指示薬:フェノールフタレイン試液1滴)。
この時、無水クエン酸の量(mg)はいくらか。1つ選べ。
- 4.905×102
- 5.03×102
- 5.15×102
- 1.51×103
- 1.545×103
正解.3
解 説
カルボキシル基 3 つが反応します。
NaOH 1mol/L、f = 1.025、7.85mL なので、中和反応に使われた OH– は 1 × 1.025 × 7.85 × 10-3 mol ・・・(1)です。
一方、中和反応に使われた H+ は、無水クエン酸を x mg = x × 10-3 g あったとすれば、無水クエン酸は x × 10-3 ÷ 192.12 mol です。1分子のクエン酸に反応するカルボキシル基が 3 つあるので、x × 10-3 ÷ 192.12 × 3 mol ・・・(2)が、中和反応に使われた H+ です。(1)=(2)が成り立ちます。
選択肢が結構シビアなので、ちゃんと計算しなければいけません。x ≒ 5.15 × 102 です。
ちなみにですが、本番では OH の H も反応するんじゃないかと考えた人もいたと思います。その場合も、計算した結果、選択肢に近い数値が見当たらないことから、カルボキシル基だけが反応するってことなのかな・・・?と、その場で推測できたのではないかと思います。
以上より、正解は 3 です。

コメント