問 題
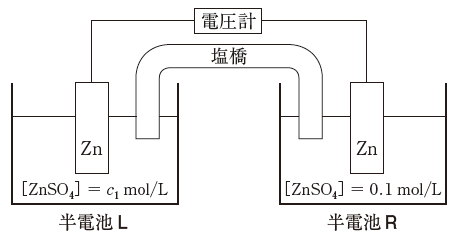
生体における膜電位の原理を理解するためには、濃淡電池の作動原理を知ることが必要である。電解質として用いる硫酸亜鉛の濃度のみが異なる2つの亜鉛半電池を塩橋でつないだ化学電池の模式図を以下に示す。
標準圧力下、298Kにおいて半電池Rの硫酸亜鉛の初濃度を0.1mol/L、半電池Lの硫酸亜鉛の初濃度をc1mol/Lとする。
なお、亜鉛半電池の反応は次式で表される(E°は標準電位を表す)。
![]()
また、硫酸亜鉛は水中では完全に電離し、その活量は濃度に等しいとする。この場合の亜鉛半電池の電極電位E(単位V)は温度298Kでは次式で表される。
![]()
この化学電池に関する記述のうち、正しいのはどれか。2つ選べ。
- この電池はダニエル電池である。
- c1=0.01のとき、半電池Lがアノード(負極)となる。
- この電池の標準起電力は0Vである。
- 半電池Lと半電池Rの硫酸亜鉛濃度が等しくなった状態の起電力は-0.76Vである。
- c1=0.01のとき、この電池の起電力は約+0.059Vである。
解 説
選択肢 1 ですが
ダニエル電池は、Zn と Cu が用いられます。よって、選択肢 1 は誤りです。
選択肢 2 は妥当な記述です。
濃淡電池では、濃度が濃い方が正極です。
選択肢 3 は妥当な記述です。
各半電池に注目した時、極板が同じなので E0 も等しいです。従って、それぞれの半電池の標準電位に違いがないため、全体を見た時、電位の差が0です。つまり、標準起電力は 0V です。
選択肢 4 ですが
濃度も等しいのであれば、どちらの電位も等しいため、起電力は 0V です。よって、選択肢 4 は誤りです。
選択肢 5 ですが
まず、半電池 R について、与えられた式より電極電位を計算します。濃度が 0.1 mol/L なので、濃度の所に 0.1 = 10-1 を代入します。
E = E0 + 0.059/2 × log10[10-1]
= E0 ー 0.059/2 です。
一方、半電池 L について、同様に計算します。C1 = 0.01 = 10-2 です。
E = E0 + 0.059/2 × log10[10-2]
= E0 ー 0.059 です。
差をとれば 0.059/2 です。0.059 ではありません。よって、選択肢 5 は誤りです。
以上より、正解は 2,3 です。
参考)物理化学まとめ 濃淡電池

コメント