問 題
下のグラフは、可逆(平衡)反応(Ⅰ)、平行(並発)反応(Ⅱ)、連続(逐次)反応(Ⅲ)における反応物、中間体及び生成物の濃度と時間の関係を表している。素反応がいずれも反応速度定数k1~k6の一次反応であるとき、反応Ⅰ~Ⅲに関する記述のうち、正しいのはどれか。2つ選べ。
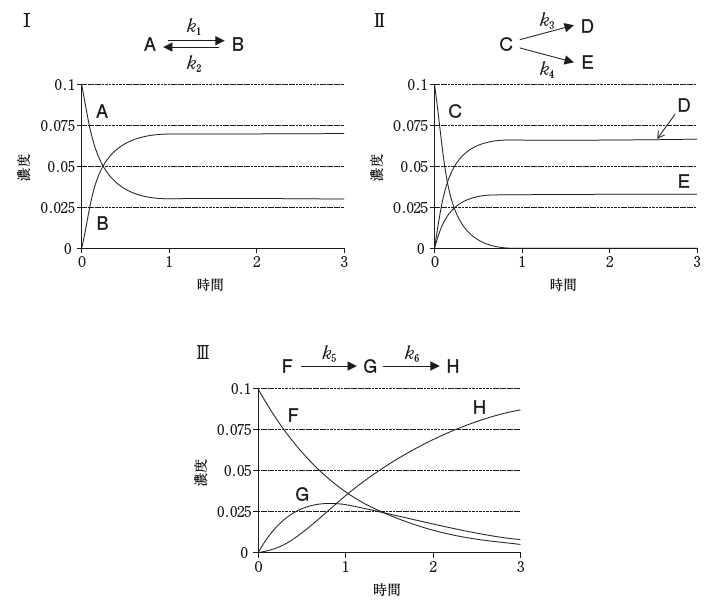
- 反応Ⅰの平衡定数の値は、1よりも小さい。
- 反応ⅡのCの半減期は、
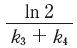 で表わされる。
で表わされる。 - 反応Ⅱの生成物の濃度比[D]/[E]は、時間によらずk3/k4となる。
- 反応Ⅲのk5が一定のとき、k6が大きくなるほど、Gの最大濃度に達する時間は遅くなる。
正解.2, 3
解 説
選択肢 1 ですが
平衡定数を K とおけば、K=[B]/[A] です。十分時間が経過した所を読むと[A]の方が少ないため、Kは明らかに1よりも大きいです。よって、選択肢 1 は誤りです。
選択肢 2 は、正しい記述です。
※以下一応導出。好きじゃない人はあまり読まなくていいと思います。

選択肢 3 は、正しい記述です。
平行反応の生成物の比は、それぞれの反応速度定数の比です。
選択肢 4 ですが
k6 がすごく小さい場合から考えるとわかりやすいのではないかと思われます。k6 がすごく小さいと中間生成物 G はなかなかHに分解されません。するとなかなかGのピークに達しません。そこから k6 が大きくなれば中間生成物 G が 分解される速度が速くなる→濃度がそれほど上昇しないでピークに達すると判断できるのではないでしょうか。
以上より、正解は 2,3 です。
参考)物理化学まとめ 微分型速度式の積分型速度式への変換
、代表的な複合反応(可逆反応、平行反応、連続反応)

コメント