問 題
次の文章の[ ]に入る数値及び記号の正しい組合せはどれか。1つ選べ。
理想溶液がその気相と平衡にある場合、各成分の蒸気圧は溶液中のモル分率に比例する。成分XとYから成る液体を理想溶液とみなすとき、成分Xのモル分率0.5の溶液と平衡にある蒸気の成分Xのモル分率は[ ① ]となる。
ただし、成分XとYの蒸気圧をそれぞれ500hPa、1000hPaとする。また、成分X、Yが理想溶液とみなせず、XとYの分子間相互作用が同種分子間の相互作用よりも弱い場合の圧力は[ ② ]のようなグラフになる。
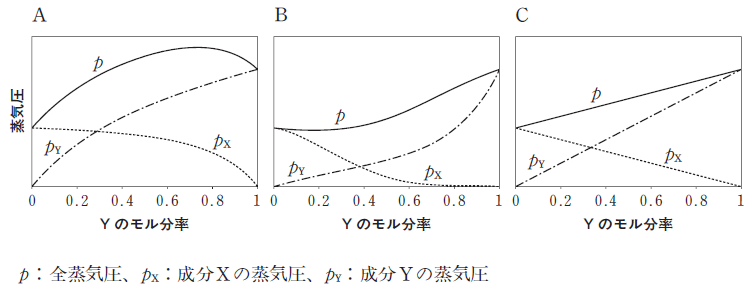
- ① ②
- 0.67 A
- 0.67 B
- 0.67 C
- 0.50 A
- 0.50 B
- 0.50 C
- 0.33 A
- 0.33 B
- 0.33 C
正解.7
解 説
成分 X の蒸気圧(Px)、及び 成分 Y の蒸気圧(Py) は、ラウールの法則より、Px : 500 ✕ 0.5 = 250、Py : 1000 ✕ 0.5 = 500 です。よって、全圧は 250 + 500 = 750 です。全圧が 750 で、そのうち 250 が成分 X の分圧ですので、ドルトンの法則より、250 / 750 ≒ 0.33 が、X のモル分率です。(① についての解説)
次に、X と Y の分子間相互作用が「同種分子間の相互作用よりも弱い場合」について考えます。まず、同種分子であれば、分子間力により「緩やかに引かれ合う」と考えられます。各分子に注目すれば、分子の運動が分子間力により制限されるイメージです。これよりも相互作用が弱いのであれば、より自由に各分子が動き回ると考えられます。
より自由に X,Y 各分子が動き回る場合、分子は「より早く動き回る」といえます。つまり、圧力が大きくなると考えられます。グラフでいうと 上に凸 となると考えられます。従って、② は A です。(②についての解説)
以上より、正解は 7 です。

コメント