問 題
理想気体A、B、C に関する次の反応を考える。
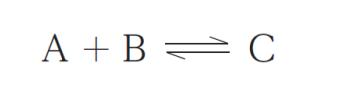
500 K におけるこの反応の圧平衡定数 Kp は 4 である。500 K において、A、B、C の分圧が、それぞれ 0. 2 atm、0. 3 atm、0. 5 atm である混合気体を、容積可変の気密容器に入れ、全圧を1 atm、温度を 500 K に保ちながら、この反応を平衡状態に達するまで行った。
この反応後の各気体の分圧に関する記述として最も妥当なのはどれか。なお、標準状態の圧力は 1 atm である。
1. 分圧が増大したのは A のみである。
2. 分圧が増大したのは A と B のみである。
3. 分圧が増大したのは B のみである。
4. 分圧が増大したのは C のみである。
5. A、B、C の分圧はいずれも変化しなかった。
正解 (2)
解 説
圧平衡定数 Kp = 4 であることから、平衡状態において、以下が成り立ちます。
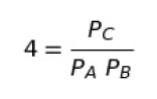
混合気体の初期状態の分圧が PA = 0.2 , PB = 0.3 , PC = 0.5 なので PC/PAPB = 0.5/0.2×0.3 = 0.5/0.06 です。これは大体 8 強です。
平衡状態に達するためには、PC/PAPB が8→4となるため、全体が小さくなる必要があります。分子、分母にそれぞれ注目すれば「分子が減って、分母が増える」必要があります。従って、分圧が増加するのは A,B と考えられます。
A,B の分圧が進むとは 「C →A+B」方向に平衡が動く ということなので、「A、B 共に」分圧が増加します。
以上より、正解は 2 です。

コメント