問 題
気体 A、B は、次式のように反応し、気体 C となる。
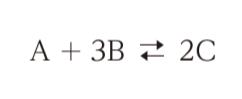
この反応を容積 0.10m3 の槽型反応器を用いて回分操作で行うことを考える。
40mol の A 、20mol の B を反応器に導入し、450K で反応させ、B の平衡転化率が 0.60 となったときの反応器内の圧力はおよそいくらか。
ただし、気体定数は 8.3 J・K-1・mol-1とし、気体 A、B、C は、いずれも理想気体として振る舞い、この反応において凝縮は起こらないものとする。
1.1.9 MPa
2.2.3 MPa
3.2.6 MPa
4.2.9 MPa
5.3.3 MPa
正解 (1)
解 説
B の平衡転化率が 0.6 ということは 60% が反応しているということです。 B は 20mol 導入しているため、20mol の 60% は 12mol です。すると、A:B の反応する物質量の比が、化学反応式から1:3なので、A は 4mol 反応し、C は 8 mol 生成された状態で平衡状態とわかります。
理想気体とあるので、PV = nRT です。n は A36、B8、C8 mol 合計して、52 mol です。R = 8.3、T = 450 を代入します。V については、0.1 m3 を代入します。(1Pa = 1N/m2 で、1J = 1N・m なので、うまく 計算の結果の単位が Pa になります。)
P = nRT/V と直してから、数値を代入すると、52×8.3×450/0.1 ≒ 1.9 × 106 (Pa)です。
以上より、正解は 1 です。

コメント