問 題
イオン結晶に関する、次の記述の ㋐、㋑、㋒ に当てはまるものの組合せとして最も妥当なのはどれか。ただし、√2 = 1.41、√3 = 1.73とする。
「塩化ナトリウム型結晶では、陽イオンは( ㋐ )個の陰イオンと近接した結晶構造となり、また塩化セシウム型結晶では、陽イオンは( ㋑ )個の陰イオンと近接した結晶構造となる。
陽イオンの半径を rM+ 、陰イオンの半径を rx- とすると、半径比 ( rM+/rx- ) は結晶構造を決める大きな要因となっている。rM+ < rx- とし、剛体球近似において陽イオンと陰イオンが必ず接するとすると塩化セシウム型結晶を安定にとり得るのは、rM+/rx- が ( ㋒ ) より大きい場合となる。」
㋐ ㋑ ㋒
1.4 6 0.41
2.4 6 0.73
3.6 4 0.41
4.6 8 0.41
5.6 8 0.73
解 説
㋐ 及び ㋑ですが
NaCl 型結晶 及び CsCl 型の配位数が 6 及び 8 であることは基礎知識です。正解は 4 or 5 です。
㋒ですが
塩化セシウム型結晶として頭に浮かぶのは真ん中に陽イオン1個の体心立方格子類似の構造です。rM+<rx- とあるので、陰イオンを表す球の方が大きいイメージです。そして、rM+/rx- が( ㋒ )より大きい場合 という問なので、rM+/rx- として取りうる最小値がある と考えられます。
「rM+/rx-が 小さくなる」 というのは、「rM+が小さく、rx- ができるだけ大きくなる」 ということです。格子のイメージを考えると、「rX-が a/2 までしか大きくできない」という上限があることがわかります。従って、以下の図のような状況が、rM+ が小さく、rx- ができるだけ大きくなる限界だろうと考えられます。
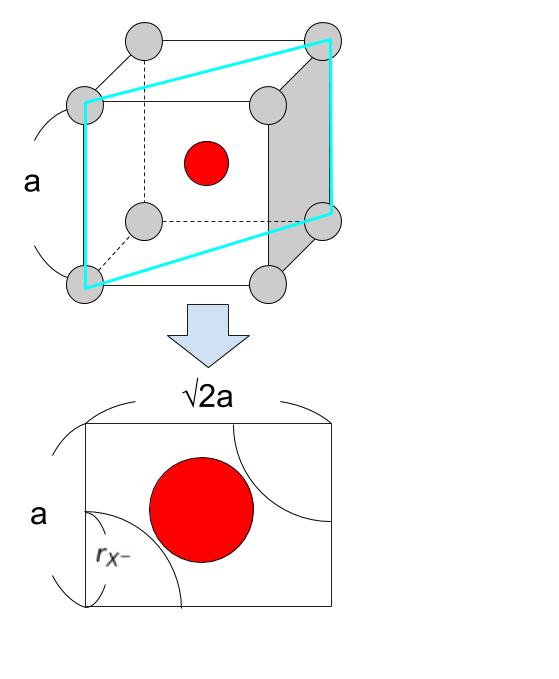
絵からいくらなんでも1:2よりも大きくはないから、正解は 5 でいいと思うのですが確実に求めるために計算しておきます。
rx- を a/2 としているので、対角線上の rX- が占める距離は ほぼ a です。一方、対角線の長さは三平方の定理から √3a ≒ 1.7a です。よって、0.7a が 陽イオンの直径です。従って、0.35a が陽イオンの半径です。0.5a :0.35a = 10 : 7 です。∴ rM+/rx- は、7/10 = 0.7 となります。近い選択肢を選べば、5 です。
以上より、正解は 5 です。

コメント