問 題
図のように、蒸発成分が蒸留装置で凝縮することなく留出する連続蒸留(フラッシュ蒸留)を考える。密閉され一定温度に保たれた蒸留装置にベンゼンとトルエンを連続的に1:1 のモル比で合計 1.00kmol/h 供給したところ、留出液量が 0.50kmol/h となった。このとき留出液のベンゼンのモル分率はおよそいくらか。
ただし、ベンゼントルエンの溶液は理想溶液と考えてよく、蒸留時の温度における純粋なベンゼントルエンの飽和蒸気圧は、それぞれ 330 kPa、150 kPaとし、√55 = 7.42 とする。
- 0.5
- 0.6
- 0.7
- 0.8
- 0.9
解 説
留出液中のベンゼンのモル分率を x とおきます。すると留出液中のトルエンのモル分率は、当然 1-x となります。
ところで、ベンゼンのみに注目すると、原料として 0.50kmol/h 入れています。で、上の留出液から 0.50 × x kmol/h 出ていっています。すると、下の缶出液側のベンゼンは
0.50 ー 0.50x = 0.50(1-x) と表せます。従って、缶出液側のベンゼンのモル分率は 1-x です。すると缶出液側のトルエンのモル分率は x です。
ここまでで、上に出ていく流出液中のベンゼン、トルエンの組成と、下に流れ出る缶出液側のベンゼン、トルエンの組成を x という文字1つを未知数として表すことができました。
さて、蒸留装置内において気液平衡が成り立ちます。(イメージが下図)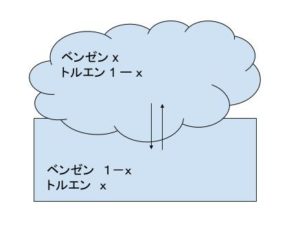
蒸気圧は理想溶液なので「330 × (1-x) + 150 × x」が全圧です。そのうち 330 × (1-x) がベンゼンの分圧です。そして、「ベンゼンの分圧/全圧」 = 「蒸気全体におけるベンゼンのモル分率」が成立します。すなわち、以下の式が成り立ちます。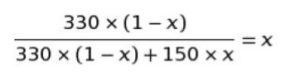
正解を選択肢から検討すると、x = 0.6 を代入すれば 等号が成立します。
以上より、正解は 2 です。
ちなみに√55 の使い所ですが、最後に出てきた式を、普通に2次方程式として解く時に出てきます。すなわち

となります。

コメント