問 題
理想気体Aから理想気体Bが生成する反応は,次のように表される。
A ⇄ 2B
温度 T0 におけるこの反応の圧平衡定数を K とする。また、標準状態の圧力を P° とする。2 molのAのみの状態から、圧力 P°, 温度 T0 の条件を保ちながら平衡に達するまで反応させたときの、系中のBの物質量として最も妥当なのはどれか。

正解 (5)
解 説
標準状態の圧力 とあるので、P0 = 1 とします。平衡なので、反応開始時と平衡時の物質量について表を考えます。
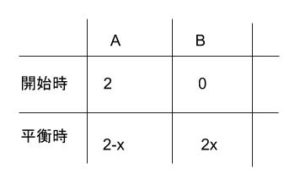
平衡時の全物質量は、(2-x)+2x = 2+x となります。圧平衡定数で、係数の和が左辺と右辺で等しくないので、平衡時の「物質量」ではなく、平衡時のそれぞれの気体の「分圧」を考えます。
P0 を保って平衡 とあるので、全圧は P0 = 1 と表すことができます。全圧は分圧の和です。それぞれの気体の分圧は、物質量の比です。(※これは基礎知識。)すなわち、PA+PB = 1 かつ、PA:PB =2-x:2x ということです。よって以下のように、PA、PB を x を用いて表すことができます。

圧平衡定数 K は
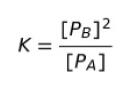 です。
です。
先程 x を用いて表した PA,PB を代入すると

となります。求めたいのは平衡時の B の物質量 2x なので、√ とって 2 をかければ
2x = 4√(K/(K+4)) です。
以上より、正解は 5 です。

コメント