問 題
質量 3.0 g の NaCl 結晶の体積はおよそいくらか。ただし、NaCl の式量は 58.5、Na+-Clー のイオン間距離は 280 pm、アボガドロ定数は 6.0×1023 mol-1とする。
- 0.35cm3
- 0.70cm3
- 1.4cm3
- 2.1cm3
- 2.8cm3
解 説
NaCl の式量から、NaCl 1mol で 58.5g とわかります。3.0g を mol になおします。選択肢間で数値がかなり幅があるので、多少雑に計算してもよいと考え 1mol ≒ 60g と近似します。すると 3.0 g → 1/20 mol です。(少し小さめに答えが出るはずです。)
アボガドロ定数より、1mol NaCl があれば 6.0 × 1023 個 NaCl があるとわかります。NaCl は 1/20 mol なので、1/20 × (6 × 1023) = 3 × 1022 個 あります。
さて、NaCl 型結晶 と来たら、陽イオンと陰イオンが交互に並んだ以下のイメージを思い出します。
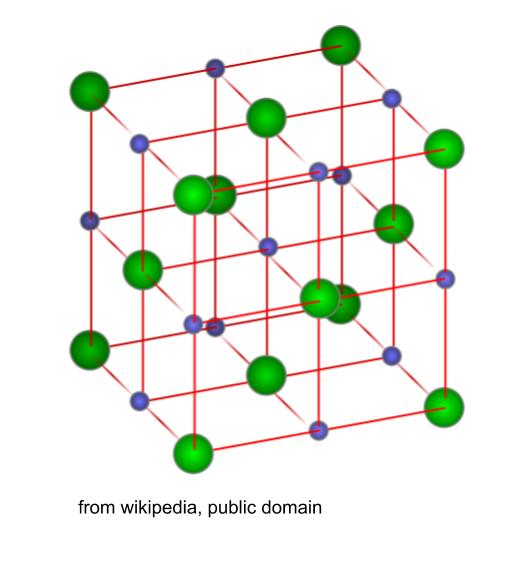
このイメージの基本単位の中に NaCl は4個あります。(数えてもいいけど、知識として覚えておいた方が楽。)そして1辺は明らかに、イオン間距離の2倍 とわかります。イオン間距離が 280pm なので、1辺は 560pm です。この立方体の体積は (560pm)3 です。
560pm 3 に 4個だけど、3 × 1022 個 ある時体積な~んだ?単位は cm3 で求めてね、という問です。以下、頑張って単位を揃えていきます。まず「p」 = 「10-12」です。そして「1m3」とは 1m 四方の箱の体積です。1m = 100cm なので、1m3 = (100cm)3 = 106cm3 となります。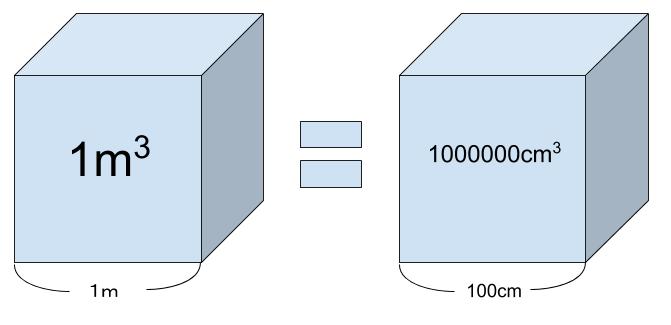
(560pm)3
=(5.6 × 102 × 10-12 m)3
=(5.6)3 × 10-30 m3
=(5.6)3 × 10-30 × 106 cm3
=(5.6)3 × 10-24 cm3 となおせます。この中に4個なわけです。よって4で割ればNaCl 1個あたりの体積がわかります♪そして 3 × 1022 をかければ晴れて答えです!
(5.6)3 × 10-24 ÷ 4 × (3 × 1022)
= (5.6)3 × 0.75 × 10-2 となります。
大雑把でいいんだから、5.6 ≒ 6 とします。(やや大きめの答えが出るはず。)63 = 216 です。先に ×10-2 すれば 2.16 です。2.16 × 0.75 なら、選択肢の中で一番近いのは 1.4 です。正解は 3 です。時間はかかってもいいから確実に解きたい問題です。ぜひ自力で正解を選べるようにがんばってください!

コメント