問 題
電気分解に関する次の記述の㋐ ㋑ に当てはまるものの組合せとして最も妥当なのはどれか。ただし、ニッケルと銅の原子量はそれぞれ 59、64 とし、ファラデー定数は 9.6× 104C/molとする。
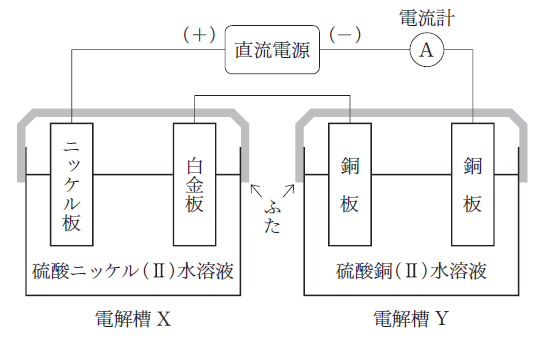
「図のように電解槽 X Y を直流電源に接続し、0.29 A で ㋐ ×104秒間電気分解を行ったところ、電解槽 X のニッケル板の質量は1.77g 減少した。このとき電解槽 Y の水溶液中の Cu2+ の濃度は㋑ 。」
㋐ ㋑
- 2.0 増加した
- 2.0 変化しなかった
- 1.0 増加した
- 1.0 変化しなかった
- 1.0 減少した
解 説
それぞれの電解槽に注目し、さらにそれぞれの極に注目します。硫酸銅(Ⅱ)水溶液の入った電解槽 Y の方が簡単なのでそちらから考えます。
【電解槽 Y について】
陰極では、溶液中の Cu2+ が電子を受け取り Cu2+ + 2e– → Cu となります。一方陽極側では、銅板が電極として用いられているためこれが溶けます。すなわち、Cu → Cu2+ + 2e– です。すると、全体を通じて Cu2+ の濃度は変化しません。正解は 2 or 4 です。
【電解槽 X について】
ニッケル板のことだけわかればよく、かつ、溶けると問題文からわかっているので、陽極において Ni → Ni2+ + 2e– ・・・(1)と考えられます。
ニッケル板の質量は 1.77g 減少したとあります。原子量が 59 なのでものすごく大雑把に評価すると、「1.77 ≒ 2」、「59 ≒ 60」と近似して、1/30 mol 減っていると考えます。そして Ni が 1/30 mol 減ったということは、式(1)の係数に注目すれば「電子が 2/30 mol 流れた」ということです。
1A で 96500 秒電流を流せば、電気量は 96500 C であり、その時電子が 1mol 流れるということは基礎知識です。(この 「96500C」 を1F と表すこともあります。電気量 1F なら、電子が 1mol 流れています。)
本問では、0.29 ≒ 0.3 A で 10000秒か 20000秒 電気を流しています。10000 秒だと
電気量が 3000C だから、大体1/30 F です。つまり電子も大体1/30 mol しか流れていません。よって、20000秒の方が正しいとわかります。
以上より、正解は 2 です。

コメント