問 題
炭素86.0wt%、水素13.5wt%、硫黄0.5wt%の組成の重油を空気比1.20で完全燃焼させたところ、煙突出口での乾き燃焼ガス中のSO2濃度が245ppmとなった。
この値は計算から予測される値より小さく、原因は煙道への空気の侵入と推定された。この場合、乾燥基準の侵入空気量は重油1kg当たり、およそ何m3Nとなるか。
- 0.9
- 1.1
- 1.3
- 1.5
- 1.7
解 説
この問題は例年の計算問題と比べても難易度の高い問題といえます。極端な悪問・奇問というわけではありませんが、計算問題に自身のない方はこの問題を一旦後回しにしたほうがいいかもしれません。
まず、最終的には重油1kgあたりの侵入空気量が問われているため、以下では重油が1kgあるものとして話を進めます。
重油を1[kg]としたとき、炭素(C)は0.86[kg]、水素(H)は0.135[kg]、硫黄(S)は0.005[kg]であり、各成分は完全燃焼によって以下のようになります。
- C:燃焼によってCO2が生成する
- H:燃焼によってH2Oが生成する(乾き燃焼ガスとしてはノーカウント)
- S:燃焼によってSO2が生成する
以上から、完全燃焼の化学反応式は次のように書くことができます。なお、赤字の数字は消費したモル数、青字の数字は生成したモル数だと考えてください。また、それぞれの原子量はC:12、H:1、O:16、S:32です。

このあとの計算では上図の化学反応式をたびたび使うことに成るので、必要に応じて参照しながら解説を読んでください。
この設問では「侵入空気量が何m3Nか」が問われています。そのため、侵入空気量A侵[m3N]を使った式を用意したいところです。ここで、問題文に「乾き燃焼ガス」という言葉があるので、乾き燃焼ガス量G(=完全燃焼後に残っているガス量)を表わす式を立てると、下記のようになります。

上式の意味を説明します。重油1[kg]を燃焼させると、最初にある予定空気量A[m3N]から消費酸素量V消[m3N]の分だけガス量が減り、発生ガス量V発[m3N]の分だけ増えます。さらに意図せず侵入空気量A侵[m3N]が追加されるので、これらのトータルとして、乾き燃焼ガス量G[m3N]は上式のように表すことができます。
よって、侵入空気量A侵[m3N]を知るためには、それ以外のパラメータが全てわかればよいということになります。つまり、この先の方針は、以下の1.~4.をそれぞれ求めることになります。
- 乾き燃焼ガス量G [m3N]
- 予定空気量A [m3N]
- 消費酸素量V消 [m3N]
- 発生ガス量V発 [m3N]
1.の乾き燃焼ガス量Gに関して、問題文に「乾き燃焼ガス中のSO2濃度が245ppm」とあるので、以下の(2)式に示す等式が成り立ちます。
![]()
ここで、燃焼で生じたSO2は解説の冒頭に示した化学反応式より0.005/32[kmol]とわかっています。気体1[kmol]の体積は22.4[m3N]なので、以下のような計算によって乾き燃焼ガス量Gを算出することができます。
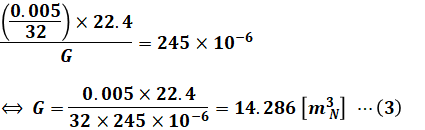
2.の予定空気量Aに関して、問題文に「空気比1.20で完全燃焼させた」とあるので、理論空気量A0の1.2倍が予定空気量Aとなります。
![]()
理論空気量A0について、解説の冒頭に示した化学反応式の酸素のところを全て足すと完全燃焼に必要な酸素のモル数が求まり、これを100/21倍すると理論空気量のモル数がわかります。そして、これに22.4を掛けることで体積に変換します。
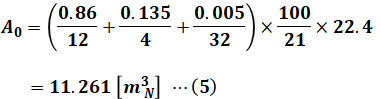
(4)式と(5)式より、予定空気量Aは次の(6)式のようになります。
![]()
3.の消費酸素量V消に関して、これも理論空気量A0を求めたときと同じように化学反応式を使って考えることができます。今度は空気量ではなく酸素量なので、100/21倍などのひと手間は必要なく、より単純な計算で済みます。
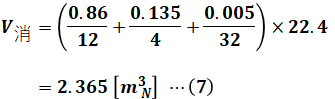
4.の発生ガス量V発に関しても、消費酸素量V消と似たような計算によって求めることができます。ただし、問題文で乾き燃焼ガスで考えることが指定されているので、水素の燃焼で生じた水蒸気については計算に入れない(=無視できる)点に注意してください。
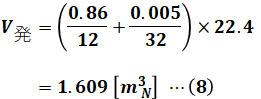
以上から、(3)式、(6)式、(7)式、(8)式を(1)式に代入すると、求めたい侵入空気量A侵[m3N]を算出することができます。

よって、正解は(4)となります。

コメント