灯油10kg/hとメタン30m3N/hを混焼するバーナーで完全燃焼させたとき、バーナー全体での空気比を1.2とするために必要な空気量(m3N/h)はおよそいくらか。ただし、灯油の組成は炭素89質量%、水素11質量%とする。
- 463
- 473
- 483
- 493
- 503
正解 (2)
解 説
灯油10kg中には炭素が8.9kg含まれています(∵問題文より灯油の組成は炭素89質量%)。炭素と酸素は以下の化学反応式の通りモル比で1:1で反応するので、完全燃焼するために必要な酸素は8.9/12[kmol]となります。

また、灯油10kg中には水素が1.1kg含まれています(∵問題文より灯油の組成は水素11質量%)。水素と酸素は以下の化学反応式の通りモル比で4:1で反応するので、完全燃焼するために必要な酸素は1.1/4[kmol]となります。
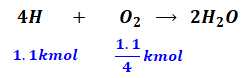
よって、灯油の完全燃焼に必要な酸素量は
![]()
となります。気体は22.4[L]で1[mol]であり、22.4[m3N]で1[kmol]とも表すことができます。そのため、上式で求めた酸素量をモルから体積に直すと、
![]()
と計算できます。
一方、メタンと酸素は以下の化学反応式の通り体積比で1:2で反応するので、完全燃焼するために必要な酸素は60[m3N]となります(このとき体積をモルに換算してもいいのですが、体積とモルは比例しますし、最終的に体積を求める問題なので、ここでは体積比のまま計算を進めます)。
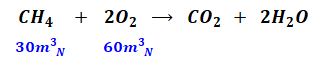
以上から、灯油とメタンの両方を完全燃焼させるために必要な酸素量の合計は
![]()
となり、酸素が82.77[m3N]のときの空気の量は、空気中の酸素の割合が21%であることから、
![]()
と計算できます。
最後に、この問題では空気比を1.2としているので、最終的に必要な空気量は、
![]()
となります。

コメント