重油を完全燃焼し、乾き燃焼ガスを測定したところ、O2濃度が4.0%、SO2濃度が412ppmであった。理論乾き燃焼ガス量を11.0m3N/kgとすると、重油中の硫黄分(質量%)はおよそいくらか。
ただし、重油中の硫黄分は燃焼によりすべてSO2になるものとする。
- 0.6
- 0.8
- 1.0
- 1.2
- 1.4
正解 (2)
解 説
乾き燃焼ガス量(理論乾き燃焼ガス量ではなく、実際のほう)をA[m3N/kg]とします。そうすると、乾き燃焼ガス量中の酸素量は(A-11.0)×0.21で表されます。
上式のうち、(A-11.0)の部分は乾き燃焼ガス量と理論乾き燃焼ガス量の差なので、余分に含まれていた空気量を指します。さらに0.21で掛けているのは、空気中の酸素の割合が21%だからです。理論空気量の分の酸素はすべて燃焼によって使われるため、余分な空気に含まれる酸素量が乾き燃焼ガス量中の酸素量になります。
一方、問題文より燃焼ガス中のO2濃度が4.0%とあるので、乾き燃焼ガス量中の酸素量はA×0.04でも表されます。
以上より、2式を組み合わせると、次式のようにAを求めることができます。
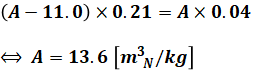
つまり、燃料1kgを燃やすと13.6m3N/kgのガスが発生するということですが、このうちの412ppm分がSO2になります。よって、SO2濃度は次のようになります。
![]()
最終的な答えは硫黄分の質量%ですので、まずはこれを22.4[m3N/kmol]で割ってmol数を出し、S(硫黄)の原子量32を掛け、最後に%にするために100倍することで質量%を算出します。
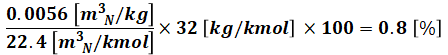

コメント