標準酸化還元電位が最も低い酸化還元反応はどれか。
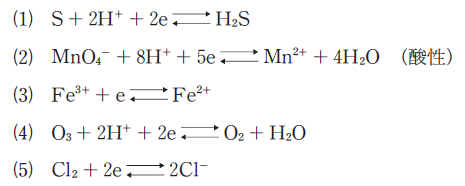
正解 (1)
解 説
酸化還元対を含む溶液に白金電極と水素電極とを入れると、両極間に電位差を生じ、これを標準酸化還元電位といいます。標準酸化還元電位の高い系は、より低い系を酸化することができます。代表的な酸化剤と、その強さは以下の通りです。
強い酸化剤として有名なのは、まずオゾン(O3)です。選択肢の(4)に当たります。
次に強いのは過酸化水素水(H2O2)や過マンガン酸塩(MnO4–)です。後者が選択肢の(2)です。
まぁまぁ強い酸化剤として、塩素(Cl2)や二クロム酸塩(Cr2O72-)などがあります。前者が選択肢の(5)です。
あまり強くないですが、3価の鉄(Fe3+)やヨウ素(I2)、2価の銅(Cu2+)なども一応、酸化剤として使われます。これが選択肢(3)です。
残るのは選択肢(1)の硫黄(単体)ですが、これはもう酸化剤と呼べるほどのものではありません(一応、硫黄によって水素が還元されているので硫黄が酸化剤なのは間違いないですが、酸化還元電位はかなり低いです)。
よって、上述の代表的な酸化剤を覚えて、そこにないから選択肢(1)が答え、という解答の仕方でいいと思います。

コメント