質量分析法によって得られるマススペクトル(MS)は、たとえば以下のようになります。
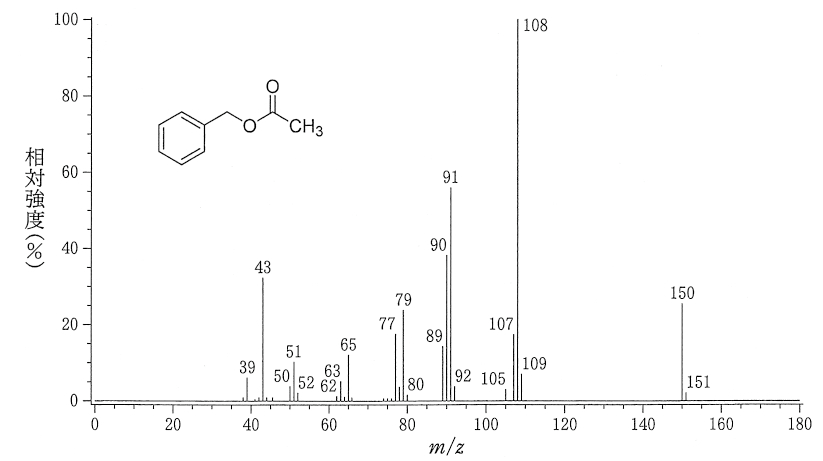
上図を見てもわかる通り、マススペクトル(MS)では横軸が m/z (質量電荷比)で、縦軸が相対強度(説明は後述)です。
1H-NMRではシグナルと呼んでいた図中の線は、マススペクトル(MS)ではピークと呼びます。これは、1H-NMRは幅を持っている線だったのに対し、こちらは面積のないただの1本線だからです。
このピークはどれも、測定対象の化合物がその数字の m/z (質量電荷比)を有していることを表しているのですが、細かく分類すると、ピークには以下の4つの種類があります。
- 基準ピーク
- 分子イオンピーク
- 同位体ピーク
- フラグメントピーク
基準ピーク
基準ピークというのは、スペクトルの中で一番背の高いピークのことです。このピークの相対強度を100%にして、基準として用います。
上図の例でいうと、m/z = 108 のピークが基準ピークとなります。
分子イオンピーク
分子イオンピークというのは、測定対象の分子量をそのまま保っているピークのことです。
もちろん、分子そのものはイオンではありませんので、分子から電子1つを取り除いて陽イオンとなったものと考えてください。電子はごく軽量であるため、電子1つ失っても分子量は変わりません。
上図の例でいうと、化合物の分子式がC9H10O2であるため、分子量は 150 です。よって、m/z = 150 のピークが分子イオンピークとなります。
一般的に、マススペクトルの最も右側にある大きめのピークが、分子イオンピークです。たとえ化合物の分子式が未知の場合でも、ここを見れば分子量を知ることができます。
ただし、フラグメンテーションを起こしやすい分子やイオン化法を用いたときは、このピークは観測されないこともあります。
同位体ピーク
大きめのピークには大体、+1 した位置にも小さいピークがありますが、これを同位体ピークと呼びます。
炭素は普通 12C ですが、同位体である 13C がおよそ 1% の割合で含まれていて、この 13C を有する分子が検出されるために、+1 の位置にピークができます。
炭素数が 1 のピークでは、同位体ピークの高さは100分の1になるのでほとんど見えませんが、炭素数が 5 であれば同位体ピークの高さは5%に、炭素数が 10 になれば10%の高さになるので、かなり見やすくなります。
上図の例でいうと、m/z = 150 のピーク(分子イオンピーク)は炭素数が 9 であるため、同位体ピークである m/z = 151 のピークの高さは、隣のピークの大体 9% くらいの高さになっています。
また、これは炭素を含むどのピークでも起こる現象なので、分子イオンピークに限った話ではありません。たとえば、m/z = 108 のピークにとっての同位体ピークは、m/z = 109 のピークです。
ちなみに、炭素以外にも同位体は存在します。同位体で有名なのは、塩素や臭素です。塩素は 35Cl : 37Cl = 3 : 1 の割合比で存在し、臭素は 79Br : 81Br = 1 : 1 の割合比で存在します。
塩素や臭素を含む化合物のマススペクトル(MS)については次の項で詳しく解説しますが、このような場合は炭素の同位体ピークよりも顕著に同位体ピークが現れます。
フラグメントピーク
分子をイオン化する段階でフラグメンテーション(開裂)を起こすことはイオン化法(イオン化部)のページで説明しましたが、その結果できるのがフラグメントイオンです。
フラグメントイオンに由来するピークのことをフラグメントピークといいます。つまり、スペクトルに載っているほとんど全て(上図でいうと150と151以外全部)がフラグメントピークです。

コメント