塩基性度とは
酸や塩基の強さを表すとき、酸の強さを酸性度、塩基の強さを塩基性度を表現することがあります。酸性度は酸性度の概要のページで解説した通りですが、塩基性度はこの酸性度を用いて計算できます。
酸の解離定数Ka の逆数に常用対数をとったものを pKa とし、塩基の解離定数Kb の逆数に常用対数をとったものを pKb とすると、
pKa + pKb = 14
が成り立ちます。
官能基による塩基性度の比較
酸性度の考え方と同様、塩基の強さを比較する場合には、塩基性度(の指標であるpKb)を比べればよいです。含窒素化合物の代表的な塩基とその塩基性度の大小関係は以下のようになります。
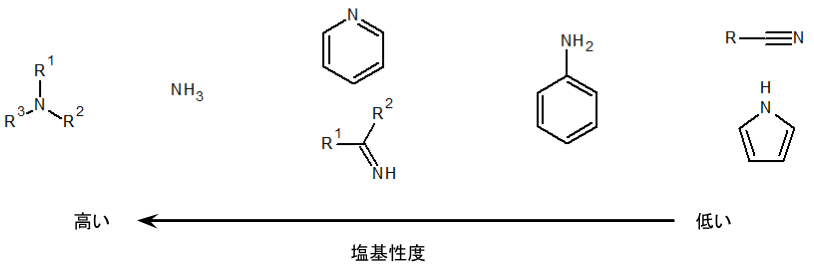
有機物の中で比較的塩基性度が高いのは脂肪族アミンです。脂肪族アミンのN原子は非共有電子対を持っていて、かつ、周辺のアルキル基が電子供与基となるので、電子密度が高いためです。
脂肪族アミンは第1級、第2級、第3級に分けられますが、塩基性度に関しては一概に順位付けできません。
というのも、第3級アミンはその共役酸の酸性が弱くなるため、第3級アミン自身の塩基性は理屈上、強い傾向にあります。しかし、第3級アミンはアルキル基がたくさん付いているので、その立体障害のせいで塩基性度は低下する影響を受けます。
よって、第3級アミンは塩基性が強くなる理由も弱くなる理由も持っていて、逆に第1級アミンは塩基性が強くなる理由も弱くなる理由も持っていないということになります。
つまり、脂肪族アミンのアルキル基によるため、これらの塩基性度は区別して覚えなくてよいと思います。
続いてアンモニアですが、これは脂肪族アミンと比べるとアルキル基(電子供与基)がない分、塩基性度が下がりますが、それでも非共有電子対を持っているので、はっきりとした塩基の性質を示します。
イミンやピリジンも非共有電子対は持つものの、隣接する炭素との二重結合により、この非共有電子対はsp2混成軌道をとっています。
よって、脂肪族アミンやアンモニアのようなsp3混成軌道に比べるとs性が大きくなり、その分、塩基としては弱くなります。
芳香族アミン(上図ではアニリン)は脂肪族アミンと異なり、塩基性度がかなり低くなります。その理由は、N上の非共有電子対が隣接する芳香環側に引っ張られ、塩基としての性質を示しづらくなるからです。
最後に、ニトリルやピロールなどは塩基性度がとても低いです。
ニトリルは構造中に三重結合を持ち、非共有電子対がsp混成軌道をとります。上記の通り、s性が高いというのは塩基性度が低い要因になります。
また、ピロールのほうは、非共有電子対が芳香族性を保つために必要なので、塩基としての役割を示せません。
上記のピリジンも同じく芳香族ですが、こちらは非共有電子対が芳香族性に関わらないため、両者の塩基性度は大きな違いが出ます。

コメント