目的の化合物を分離・精製する方法には、蒸留や再結晶、クロマトグラフィー、抽出などがあります。蒸留は各種化合物の沸点の違いを、再結晶は結晶構造の違いを、クロマトグラフィーなら極性の違いを利用しています。
この項では官能基の性質を利用した抽出について説明します。官能基を利用する分離・精製方法として代表的なものが抽出で、官能基の
- 水溶性と脂溶性(疎水性)
- 酸性度と塩基性度
という 2 組の性質を利用します。
水溶性と脂溶性
例えば 2 種の化合物を分離したいとき、一方(A)が水溶性で他方(B)が脂溶性であるとします。この場合、分液漏斗に水と酢酸エチルと混合物を入れて振り混ぜると、混合物のうち A は水層に溶け込んで B は有機層(酢酸エチル層)に溶け込むため、分離することができます。
例えば目的の化合物が B であれば、エバポレーターという溶媒をとばす装置で酢酸エチルを除去すると、欲しかったBのみを得ることができます。これが、官能基の水溶性と脂溶性(疎水性)の違いを利用した抽出です。
水溶性基に該当する官能基には以下のようなものがあります。
- -OH (ヒドロキシル基)
- -COOH (カルボキシル基)
- -NH2 (アミノ基)
- -SH (チオール基)
- -SO3H (スルホ基)
これらの置換基は全て、官能基の中に電荷の偏りが見られます。-OH でいうなら、O 原子の電気陰性度は 3.4 で、H原子のそれは 2.2 です。
一方で溶媒である水(H2O)も同じく電荷の偏りがあるため、これら官能基と水との親和性は高くなります。また、水素結合も水溶性の強さに寄与します。
脂溶性基(疎水性基)は以下のようなものです。
- -R (アルキル基・芳香族炭化水素)
- -COOR (エステル基)
- -OR (アルコキシ基)
- -X (ハロゲン)
上記のものは分子内での電荷の偏りが小さいため、水との相性が悪いです。
酸性度と塩基性度
分離したい 2 種の化合物が両方とも脂溶性だった際には、上述のような抽出をしても意味がありません。そのような時には、官能基の酸性度・塩基性度に着目します。
例えばカルボン酸(R-COOH)は酸性ですので塩基性の NaOH と反応します。その結果、 R-COO–Na+ というカルボン酸塩を形成しますが、この塩は水に溶けます。
よって、カルボン酸とエーテルの混合物を分離しようとするなら、水酸化ナトリウム水溶液を加えてカルボン酸を水溶性の塩にすることで抽出可能な状態に変えるというわけです(エーテルはもともと中性であり、水酸化ナトリウムとは反応しません)。
このように、官能基の酸性度・塩基性度を利用すると、より分離・精製のできる幅が広がります。
抽出操作のまとめ
上記の通り、酸性度と塩基性度、水溶性と脂溶性という2組の性質を利用することで、有機化合物をある程度には分離・精製することができます。
例えば4つの化合物(フェノール・カルボン酸・エーテル・アミン)を分けるとしたら、以下のような操作をすれば良いです。
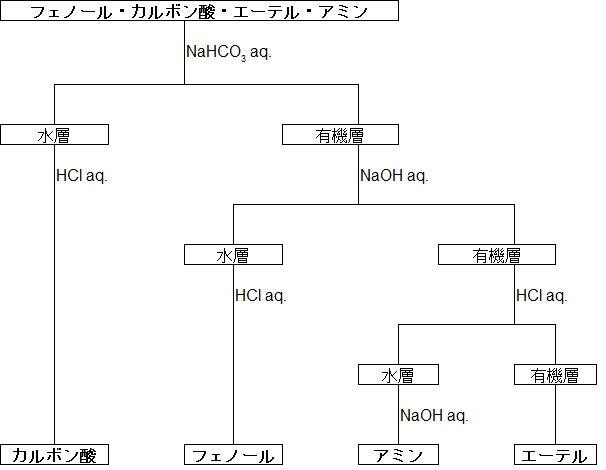
この例でいくと、はじめに NaHCO3 aq. (弱塩基)を加えることで酸であるカルボン酸が塩となって水層へ移行します。この時、弱酸であるフェノールとは反応せず、フェノールは有機層に残ります。もちろん、アミン(塩基性)やエーテル(中性)も NaHCO3 とは反応しません。
ここで水層に強酸である HCl aq. を加えると、水に溶けていたカルボン酸塩が再びカルボン酸として遊離するため、単離できます。
次に、有機層に NaOH aq. (強塩基)を加えると、今度は弱酸であるフェノールがナトリウム塩を形成し水溶性に変わります(もし先ほどの NaHCO3 aq. の過程を経ないで NaOH aq. を入れた場合、カルボン酸もフェノールも水層へと移行するため分離できません)。
水層へと移ったフェノールのナトリウム塩(ナトリウムフェノキシド)を単離するには、カルボン酸の遊離の時と同様、HCl aq. を加えます。
続いて、残った有機層に HCl aq. (強酸)を加えると、塩基であるアミンが塩を形成し水層へと移行します。その水層にアミンよりも強い塩基である NaOH aq. を加えればアミンが遊離するため、単離できます。
そして最後まで有機層に残っているものがエーテルということになります。
演習問題)99回薬剤師国家試験 問10

コメント