芳香族化合物の反応性
置換ベンゼンはその置換基によって求電子置換反応の反応性が上がったり下がったりします。例えば前項で簡単に触れた通り、アルキル基は求電子置換反応の反応性を強め、アシル基では逆に反応性を弱めます。
反応を促進するような置換基のことを「活性化基」といい、反応を抑制するような置換基のことを「不活性化基」といいます。
求電子試薬が反応しやすい置換ベンゼンの置換基(=活性基)とは、ベンゼン環の電子密度を増すような置換基です。逆にベンゼン環の電子密度を低下させるような置換基では、求電子試薬を引き寄せづらくなるため、その反応性は低下します。
このページの下のほうで、具体例とともにより詳しく説明します。
芳香族化合物の配向性
ベンゼンに何か1つの置換基がつくときは C6H6 のどの H と置換しても全く同じ生成物が得られますが、すでに1 つの置換基を持つ芳香族化合物の場合は、もうひとつの置換基を導入しようとすると、次の3 種の生成物が考えられることになります。
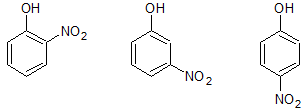
(左)o置換体 (中)m置換体 (右)p置換体
上図ではフェノールに対して1 つのニトロ基を置換しています。置換基の位置は、上図左から、o(オルト)位、m(メタ)位、p(パラ)位と呼びます。
詳しい反応機構は後述しますが、置換ベンゼンの置換基(フェノールなら -OH 基)によって次の置換基が o 位、m 位、p 位のどこに置換しやすくなるかがある程度決まります。これを配向性といいます。
ここで、o 配向性を示す置換基と p 配向性を示す置換基は同一であることから、これらをまとめて o,p 配向性と呼ぶことが一般的です。o,p 配向性を示す置換基には、-NH2、-OH、-OR、-NHCOR、-R、-Xなどがあります(R はアルキル基、X はハロゲンを指します)。
一方、m 配向性には、-NO2、-CN、-CHO、-COR、-COOH、-COOR などがあります。
以上に具体例を多く挙げましたが、無理に暗記しようとする必要はありません。次に説明する共鳴式を自分で書けるようになれば、覚えずとも導くことができます(頻出する置換基については自然に配向性を覚えていくとは思いますが)。
活性化基、o,p 配向性
上に挙げたo,p 配向性の置換基のうち、ハロゲンを除くもの(-NH2、-OH、-OR、-NHCOR、-R)は全て活性基です。
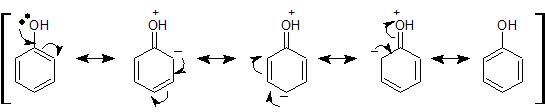
これらの置換基はベンゼンに直接結合している原子(N やO)が非共有電子対を持つため、下図のような共鳴効果によって芳香環の電子密度が高まり、反応性が上がります(活性基)。
また、置換基がアルキル基の場合は非共有電子対はありませんが、やはり電子供与基ですので、これも電子密度は高め、活性基となります。
一方、以下のような共鳴効果により、o,p 配向性を示すこともわかります。下図の負電荷がついた部分に求電子試薬がアタックすると考えてください。
不活性化基、o,p 配向性
ハロゲン原子が置換基の時も、上記の-OH や-NH2 の時と同様に共鳴構造を書けるため、o,p 配向性を示します。しかし、ハロゲン原子の電気陰性度が高いため、共鳴効果よりも強く誘起効果が効いてきて、ベンゼン環の電子密度は低くなっています。
よって、反応性は下がるため、ハロゲン基は不活性基に分類されます。
不活性化基、m 配向性
m 配向性を示すものは全て不活性基で、具体例として-NO2、-CN、-CHO、-COR、-COOH、-COORが挙げられます。
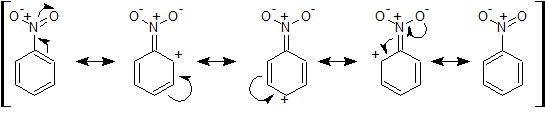
これら置換基は、ベンゼンに直接結合している原子(CやN)がさらに隣の原子(Oなど)から電子を引っ張られているため、電子不足となります。
そうするとベンゼン環のほうから電子を求引することになり、結果としてベンゼン環の電子密度が下がります。よって、これらの反応性は低下するため、不活性基となります。
また、以下のような共鳴効果によって o 位と p 位に正電荷がつく構造が書けます。求電子試薬は電子の豊富なところにアタックしやすいため、逆に正電荷のあるところだと近づきにくくなります。そうすると、正電荷のない m 位に対して反応が起こりやすくなります。
このように m 配向性とは、積極的に起こるものではなく、反応性が低い中で相対的に m 位で反応しやすいといったような消極的な配向性です。

コメント