有名な有機反応のひとつに、Diels-Alder(ディールス・アルダー)反応というものがあります。これは、共役ジエンにアルケンが付加して不飽和 6 員環構造を形成する、[4+2]付加環化反応です。
と、言葉を並べただけではわかりづらいのですが、その化学反応式は以下のようにわかりやすいものです。
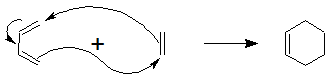
上図は、共役ジエンであるブタ-1,3-ジエンと、アルケンであるエチレンとの反応です。2 つの化合物が、矢印で示した電子の移動により、6 員環を形成していることがわかると思います。
この反応においては、
- 基質の共役ジエンについて
- 基質のアルケンについて
- 生成物のシクロヘキセン誘導体について
のそれぞれで知っておいてほしいことがあります。
まず1. については、共役ジエンは s-trans 配座ではなく、s-cis 配座で反応が進行するということです。(s-cis、s-transについては前項を参照してください。)
というのも、分子模型を組み立てるとはっきりするのですが、s-trans 配座の状態では 6 員環を形成する際のひずみが大きすぎて、結合させるのが不可能です。
一方の s-cis 配座であればアルケンとの結合を作りやすく、簡単にシクロヘキセン構造を取ることができます。こちらもやはり、一度分子模型を組み立ててみてください。
続いて2. について、アルケンは sp2 炭素に電子求引性基があると、Diels-Alder 反応が進行しやすくなります。
なぜかというと、上記の反応式をみてもわかるように、この反応では電子豊富な共役ジエンが求核剤となってアルケンを攻撃しています。その際、アルケンが電子不足であるほうが電子の受け渡しがスムーズにいく、という理屈です。
この考え方から一歩進めば、共役ジエンには電子供与基が付いているほうが反応は進みやすい、と言うこともできます。
(実際には、アルケンは電子求引性基が付いていることが多い一方、ジエンには電子供与性基がない場合もしばしばあります。)
最後に3. について。これは生成物の立体がテーマであり、ここが一番重要なところです。生成物の立体については具体的には 2 つのことを考えなくてはなりません。
まず最初は、「立体の保持」ということについてです。上記の反応例では立体についてわかりづらいので、以下の反応例を見てください。
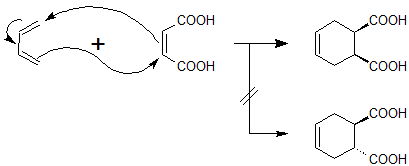
この例では、出発物質のアルケンに 2 つの置換基(-COOH)が cis の位置で付いています。その時、生成物においても置換基が cis の位置関係になります。これが「立体の保持」です。
一見当然のことと思えますが、これは Diels-Alder 反応がペリ環状反応だから起こる現象です。ペリ環状反応とは、環状の遷移状態を取る一段階の反応のことです。
もしこれが多段階の反応であり、カチオンやアニオン中間体を経ると仮定すると、その生成物はよりエネルギーの低い trans 体となるかもしれません。しかし、一段階の反応であると立体が変わる瞬間が有り得ないため、基質の立体が保持されることになります。
生成物の立体について大事な 2 つめのことは、「endo(エンド)則」についてです。例えば以下のような Diels-Alder 反応では、生成物が2種類考えられます。
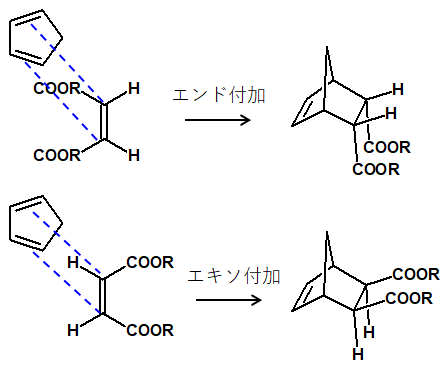
上図の上段と下段では2つの出発物質は一緒ですが、反応する際の両者の向き合い方が異なります。その結果、生成物も変わってきます。
上段のような向きの反応を endo(エンド)付加、下段のような向きの反応を exo(エキソ)付加といいますが、生成物を比較するとわかる通り、exo 付加体のほうが置換基が equatrial 位にあるため安定です。つまり、熱力学的支配に従っているといえます。
しかし、実際には Diel-Alder 反応は一般的に速度論的支配が優先され、その結果として endo 付加体ができます。Diel-Alder 反応については生成物の安定性に逆らって endo 付加が進行する場合が多く、これを「endo則」または「endo rule」と呼ぶことがあります。
ちなみに、上図で-COOR と書いた置換基の部分があまりにも大きかったりすると、さすがに立体障害が大きすぎてendo 則に従わないこともあります。その場合、生成物は exo 付加体になります。
Diels-Alder 反応では、安定でないほうの生成物が優先される(endo 則に従う)という特徴がとても重要ですので、ぜひ覚えておいてください。

コメント