シクロヘキサンの立体配座
前項の説明の通り、シクロヘキサンは6つの炭素が平面上に並んでいるわけではなく、折れ曲がった形を取ることで安定な構造を保っています。
前項では「いす形配座」を取ることにより安定していると説明しましたが、より具体的には、もうひとつ「舟形配座」を取ることもあり、これらの平衡が成り立っています(ただし、平衡はより安定ないす形に偏ります)。
この「いす形配座」と「舟形配座」の関係を、配座異性体といいます。
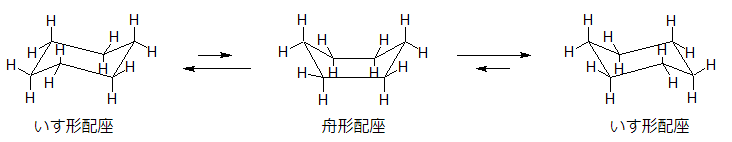
上図を見てもわかるように、いす形配座では各々の炭素同士・水素同士がどれも離れているために安定性が高いです。
一方、舟形については、炭素同士・水素同士がやや近づく箇所がどうしてもできてしまうため、相対的には不安定な構造ということができます。
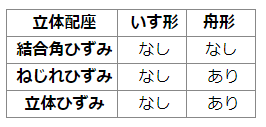
しかし、どちらも結合角ひずみはないため、そういう意味では安定な構造といえます。
まとめると、以下の表のようになります。
置換シクロヘキサンの立体配座
シクロヘキサンにメチル基が1つ付くと、メチルシクロヘキサンになります。その構造は以下の通りです。
しかし、この構造を先ほどのいす形配座として表記すると、以下の2通りの書き方ができます。
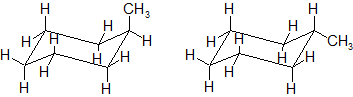
上の2つの構造では、メチル基がいす形配座の垂直方向に出ているか、水平方向に出ているかといった違いがあります。
この時、垂直方向の結合を「axial(アキシアル)結合」といい、この位置を「axial位」と呼びます。一方、水平方向の結合は「equatorial(エクアトリアル)結合」といい、この位置が「equatorial位」です。
ここで、この2つの立体配座の安定性について考えてみます。まず、次の図を見てください。
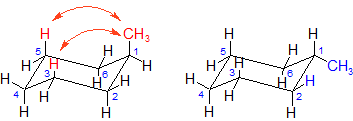
上図が先ほどの図に少し手を加えただけです。構造自体は全く変えていません。
左の構造はメチル基が axial 位にありますが、このメチル基が3位や5位の axial 位にある水素原子と空間的に近いため、ここに立体反発を生じます(図の赤矢印)。
このように、1位と3位の炭素についた axial 位の原子(原子団)同士が接近しあうことで立体反発が生じることを、1,3-diaxial 相互作用といいます。「di-」が「2」という意味なので、2つの axial 基による相互作用ということです。
また、5位のほうも1位から反時計回りに数えれば3位となりますので、やはり 1,3-diaxial 相互作用という呼び方をします。
一方、右の構造はメチル基が equatrial 位にあります。こちらは2位の水素原子(青字のH)が近くにあるため立体反発が強そうですが、実際には違います。ここが紙面の錯覚のようなものですので、ぜひ分子模型を組んで確認してみてください。
結果的には、equatrial 位では大きな立体反発もなく、axial 位よりも安定な立体配座であるということができます。
今まではメチルシクロヘキサンの話をしました。これが二置換であるジメチルシクロヘキサンになるとどうなるか。
ここは感覚でわかると思いますが、最も安定な立体配座は2つのメチル基がともに equatrial 位にある場合です。逆に2つとも axial 位にある場合は最も大きな 1,3-diaxal 相互作用が生じるため、不安定になります。
1つが equatrial 位、もう1つが axial 位にある場合は、安定性も上述の2つの中間であると考えてください。
また、1,3-diaxal 相互作用は立体的な混み具合によって生じる力ですので、メチル基と水素原子の相互作用よりはメチル基同士の相互作用のほうが大きいですし、例えばメチル基とエチル基の相互作用だとさらに大きい、ということになります。
原子(原子団)の大きさを考えれば良いだけなので、ここも感覚的に理解しやすいと思います。

コメント