典型元素とは、周期表の1,2,13~18族の元素のことを指します。最外殻電子配置は元素の化学的性質に大きく影響しますが、各族はそれぞれ最外殻の電子数(=価数)が等しいため、同じ族の元素同士は化学的性質が似ています。
残りの3~12族の元素は遷移元素と呼ばれます。
典型元素では、周期表の右上に位置するものほど電気陰性度が高く、陰イオンになりやすいという特徴があります。逆に周期表の左下に位置する元素ほど、陽イオンになりやすいです。
1族の元素
1族の元素は
- 水素(H)
- リチウム(Li)
- ナトリウム(Na)
- カリウム(K)
- ルビジウム(Rb)
- セシウム(Cs)
- フランシウム(Fr)
です。これらは、最外殻のs軌道に1つの電子を持ちます。
また、水素以外は全て金属で、これらを総称して「アルカリ金属」といいます。どのアルカリ金属も似た性質を持っていて、電子を1つ失うと安定な陽イオンになります。
さらに、アルカリ金属は炎色反応を示します(Li → 赤、Na → 黄、K → 紫)。
有機化学においては1族元素といえば H、Li、Na、K を知っていれば十分です。一部の触媒反応などで Rb 試薬などを用いることもありますが、基礎を抑える際は必要ありません。
水素は有機化合物のほとんどに含まれている元素です。単体の水素ガスは H2 で表され、燃料などに用いられます。
リチウムは電気自動車の電池として使われたり、有機反応では還元剤として使われることが多いです。
ナトリウムは海水や岩塩に大量に存在し、生体にとっても重要な電解質のひとつです(細胞外電解質)。
カリウムも海水中などに多く含まれ、生体内では細胞内電解質として重要な元素です。また、植物の主要栄養元素でもあるため、肥料などに多く含まれます。
2族の元素
2族の元素は
- ベリリウム(Be)
- マグネシウム(Mg)
- カルシウム(Ca)
- ストロンチウム(Sr)
- バリウム(Ba)
- ラジウム(Ra)
ですが、よく使うのは Mg、Ca です。最外殻の s 軌道に 2つの電子を持ちます。そのため、電子を 2つ失うことで安定な 2価の陽イオンになります。
Be、Mg を除く第 4 周期以降の 2族元素を総称して「アルカリ土類金属」と呼び、アルカリ土類金属同士は性質が似ています。
その例に炎色反応があり、Ca → 橙、Sr → 紅、Ba → 黄緑を呈色しますが、アルカリ土類金属でない Be や Mg では炎色反応が起こりません。
マグネシウムは代表的なミネラルとして、食品や医薬品、肥料などに広く含まれています。その反応性の高さから、有機反応においてもグリニャール試薬などとして頻繁に用いられます。
カルシウムは言わずと知れた、歯や骨の構成成分です。石灰岩などの形で、地殻中にも多く存在します。
13族の元素
13族の元素は
- ホウ素(B)
- アルミニウム(Al)
の 2 元素のみが頻出です。最外殻の s 軌道に 2つ、p 軌道に 1つの電子を持ちます。
ルイス酸の項でルイス酸の例として BF3 や AlCl3 を挙げましたが、このように 3 価の化合物を形成します。
14族の元素
14族の元素は重要なものが多く、
- 炭素(C)
- ケイ素(Si)
- スズ(Sn)
- 鉛(Pb)
などがあります。外殻の s 軌道に2つ、p 軌道に 2 つの電子を持ちます。
炭素は有機化合物にはなくてはならない要素ですし、単体としては黒鉛、ダイヤモンド、フラーレンなどの同素体があります。
ケイ素は SiO2 のかたちで岩石などの主要な構成要素です。また、ガラスの原料にもなっています。
スズは単体でも金属として有用ですが、鉛との合金である「はんだ」や、銅との合金である「青銅」としても用いられます。また、有機反応においても有機スズ化合物が試薬として使われます。
鉛は鉛蓄電池が有名です。また、テトラエチル鉛のような有機鉛は毒性が強いため、その使用範囲は縮小方向にあります。
15族の元素
15族の元素は
- 窒素(N)
- リン(P)
の2つが大事です。外殻の s 軌道に 2 つ、p 軌道に 3 つの電子を持ちます。
窒素は単体として大気の主成分であり約 78% を占めます。無機化合物ではアンモニアも重要ですし、有機化合物としてはアミノ酸やタンパク質、核酸などの構成要素でもあります。また、肥料にとっても必須元素です。
リンは単体だと白リン(黄リン)や赤リンなどいくつかの同素体があります。肥料としても多用され、前述のカリウム・窒素とリンを合わせて肥料の三要素といいます。また、DNA や RNA の構成元素でもあります。
16族の元素
16族の元素は
- 酸素(O)
- 硫黄(S)
などがあります。外殻の s 軌道に 2つ、p 軌道に 4つの電子を持ちます。そのため、2 つの電子を受け取って安定化します。
酸素は大気中の成分の約 21% であり、地殻中でも酸化物やケイ酸塩、炭酸塩などのかたちで多く含まれています。有機化合物でも炭素、水素に次ぐ頻出原子であり、その例を挙げたら数え切れないほどです。
硫黄は火薬、合成繊維、医薬品、ゴムなど様々な用途で用いられる元素で、硫酸なども良く使われます。
17族の元素
17族の元素は
- フッ素(F)
- 塩素(Cl)
- 臭素(Br)
- ヨウ素(I)
があります。これら17族元素を総称して「ハロゲン」と呼んでいます。ハロゲンは外殻の s 軌道に2つ、 p 軌道に5つの電子を持ちます。
また、個々の元素記号は F や Cl などですが、ハロゲン元素であることを示すために「X」を使うことも多いです。X2 と表記してある場合、Cl2 と読んでも Br2 と読んでも構わないということです。有機化学ではハロゲンを含む反応が多くあるので、この表記には慣れておく必要があります。
ハロゲンの性質は体系的に覚えておきたいところなので、以下の表にまとめます。
表1.ハロゲンの性質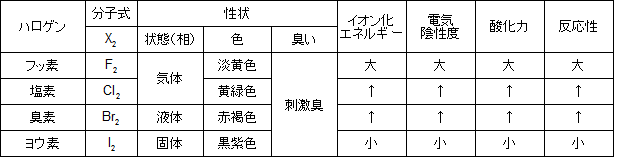
表2.ハロゲン化水素の性質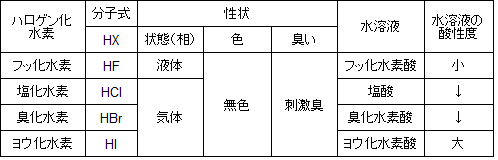
18族の元素
18族の元素は
- ヘリウム(He)
- ネオン(Ne)
- アルゴン(Ar)
などがあり、これら18族元素を総称して「希ガス」といいます。
He に限り、第1周期のために 1s 軌道に 2 つの電子を持つことで閉殻構造となります。その他については、最外殻の s 軌道に 2 つ、p 軌道に 6 つの電子を持ち、8 電子則を満たしているため、やはり閉殻構造となります。
よって、希ガスは安定ですので、化学的に安定であり、化学反応を起こすことはほとんどありません。
遷移元素
典型元素以外の元素を遷移元素といい、周期表では 3~12 族までの元素がそれに当たります。これらは全て金属なので、遷移元素のことを遷移金属という場合もあります(全く同じ意味です)。
上記で典型元素を族ごとに紹介したのは族ごとに似通った性質を示すためですが、遷移元素の場合は同じ族の元素を比べても、それほど類似が見られません。むしろ、同じ周期の元素同士の性質が似ているという特徴があります。
また、典型元素では s 軌道、p 軌道に電子が入っていましたが、遷移金属では d 軌道や f 軌道に電子が満たされていきます。d 軌道に電子が満たされていく元素は d ブロック元素と呼ばれ、f 軌道に電子が満たされていく元素は f ブロック元素と呼ばれます。
典型元素の金属と、遷移元素(遷移金属)を比べた時、一般に遷移元素のほうが比重が重く、融点が高いです。典型元素の金属 → 軽金属、遷移元素 → 重金属という覚え方でいいかもしれません。
また、遷移元素は複数の酸化数をとります。例えばFe2+とFe3+やCu+とCu2+といった具合です。一方の典型元素は、その酸化数が決まっていました。
遷移元素の単体、化合物、イオンのどれに関しても、色のついたものが多いことも特徴のひとつです。色は赤や青や緑…等々、様々な種類があります。一方の典型元素は無色、白色、銀色がほとんどです。

コメント