分子内の二重結合や三重結合または環構造の場合、その結合はたやすく回転することができません。一方で単結合の場合は、その結合を自由に回転させることができます。
しかし、回転によって生じる原子の空間配置は様々で、空間的に有利な場合も不利な場合もあります。この空間配置のことを立体配座といい、空間的な有利・不利の度合いが、立体配座の安定性です。
エタンの立体配座
エタンは分子式CH3-CH3で表されるように、メチルとメチルが単結合でつながった構造をしています。その単結合の状態によって、例えば以下のような構造が書けます。

図1.エタンの重なり形配座 図2.エタンのねじれ形配座
単結合は自由に回転させてよいので、図1のエタンのC-C結合を60°回転させると、図2のように表すことができます。
図1のNewman投影式を見るとHとHが重なっていることがわかります。原子(原子団)同士が近接していると、空間的に狭くなりエネルギー的に不利となります。これを「立体ひずみ」といいます。
一方、図2を見るとそれぞれのHは適度に離れていますので、こちらはエネルギー的に安定な配座となります。もちろん、図1と図2の間の配座も考えられますが、そのような配座の時はその安定性についても図1と図2の間となります。
また、図1のような状態を「重なり形」、図2のような状態を「ねじれ形」と呼んでいます。
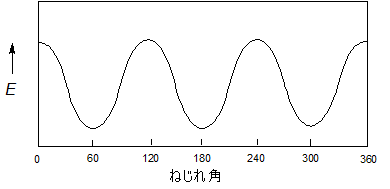
図3.エタンの回転によるポテンシャルエネルギー図の推移
ブタンの立体配座
ブタンについてもエタンと同じように考えることができますが、炭素数が多い分、少しだけ事情が異なります。先ほどと同様、以下にブタンのNewman投影式を記します。
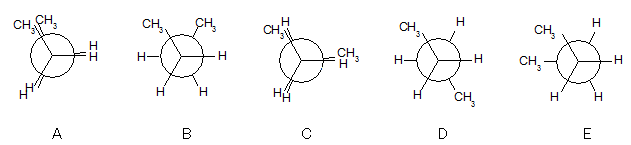
図4.ブタンのNewman投影図
図4のAの立体配座は、CH3とCH3が重なっていることがわかります。これは重なり形のため、エネルギー的に不安定です。この構造の単結合の前面を固定し、後方を時計回りに60°回転されるとBの配座になります。
さらに60°回すと再び重なり形になりますが、ここではCH3とHが重なるため、先ほどのAの構造とは少し違ったCになります。そしてさらに60°回転させるとねじれ形(D)、次に120°回転させると、これもねじれ形(E)になります。
ここで、ともに重なり形であるAとCを見てください。2つの違いは前述の通り、Aの配座がCH3とCH3の重なりであるのに対し、Cの配座はCH3とHとが重なっています。
原子(原子団)としてはHよりもCH3のほうが大きいため、当然立体障害もAの配座のほうが大きくなり、結果としてより不安定になります。
今度はB,C,Dの配座に注目すると、こちらはいずれもねじれ型配座であることがわかります。
原子(原子団)同士が離れているためにどれも比較的安定ですが、BやEは2つのCH3が隣同士に並んでいるのに対し、Dでは2つのCH3が正反対に位置しています。よって、大きい原子団同士がより離れているDは、BやEよりも安定であるといえます。
このように、同じねじれ形でも置換基が相互に60°の位置に並ぶ場合と正反対(180°)の位置になる場合がありますが、前者をゴーシュ形、後者をアンチが形と呼んで使い分けています。
以上をまとめると、下の図5のようになります。
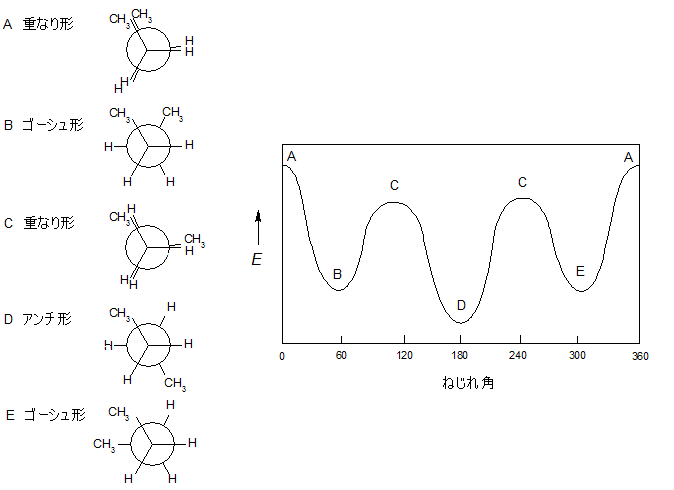
図5.ブタンの回転によるポテンシャルエネルギー図の推移

コメント