問 題
反応 A → B において、A の初期濃度 [A]0 を変えて初期反応速度 v0 を 3 回測定すると、次の表のような結果となった。
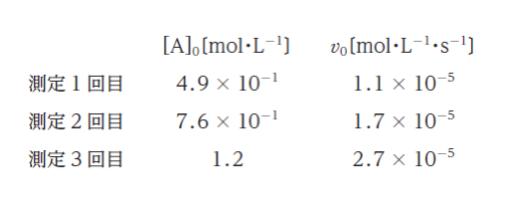
この反応における A の半減期として最も妥当なのはどれか。ただし、loge 2 は 0.69 とする。
1. 1.6 h
2. 8.5 h
3. 12 h
4. 93 h
5. 510 h
正解.2
解 説
半減期は、0 次反応、1 次反応、2 次反応で公式が変わります。
表の結果から、A の初期濃度 [A0] が 1 回目 → 2 回目では 0.49 → 0.76 と、大体 1.5 倍になると、v0 も 1.5 倍ぐらいになっています。また、1 回目 → 3 回目では 0.49 → 1.2 と、大体 2.4 倍になると、v0 も 2.4 倍ぐらいになっています。
従って
[A0] に [v0] が比例していると考えられます。1 次反応です。v = k[A] と表されます。
1 次反応の半減期は ln2/k です。一例として v = 2.7 × 10-5、[A] = 1.2 を代入して、k を求めます。k = 2.7 × 10-5/1.2 です。半減期は 0.69 ≒ 0.7 とみなして 0.7/(2.7 × 10-5/1.2) と表せます。選択肢の単位が h です。1 h = 3600 秒 だから 3600 で割ります。
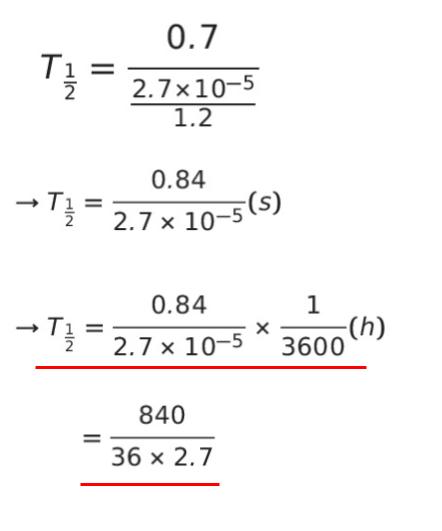
選択肢から最も近い値を選ぶと 8.5 h です。
以上より、正解は 2 です。

コメント