問 題
次の平衡反応について考える。
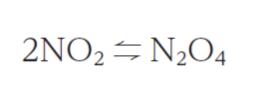
この反応の 298 K における標準反応ギブズエネルギーを -4.0 kJ・mol-1、標準反応エンタルピーを -57 kJ・mol-1 とする。圧平衡定数を KP とするとき、500 K における lnKP として最も妥当なのはどれか。
ただし、気体定数を 8.31 J・K-1・mol-1 とし、標準反応エンタルピーは 298 K から 500 K の間で変化しないものとする。
1. -7.7 × 10-3
2. -7.7
3. 3.5 ×10-2
4. 1.6
5. 35
解 説
298K において
ΔG = -RTlnK より
lnK = -ΔG/RT
∴lnK =-(-4000)/(8.31 × 298) です。
分母を 8.3 × 300 とすれば 2490 ≒ 2500 として
大体 lnK = 1.6 と評価します。
500K における平衡定数を K2 とします。また、先程の 298K における平衡定数を K1 とします。ファントホッフの式より
lnK2 ー lnK1 = ー(ΔrH/R) × (1/500 – 1/298) です。
lnK2 ー 1.6 = ー(ー57000/8.31) × (1/500 – 1/298) となります。
8.31 ≒ 8.3、1/500 – 1/298 ≒ 1/500 – 1/300 = ー1/750 とすれば
lnK2 ー 1.6 = ー 76/8.3 となります。
平衡定数 K と圧平衡定数 Kp の関係は、化学反応式の係数 『左辺の和』ー『右辺の和』 = 2 ー 1 = 1 なので、Kp = K/RT となります。
ln Kp を求めると
最も近い値が選択肢 2 なので、正解は 2 と判断できます。
※値がちょうど 2 倍ぐらいになります。どこかで2で割るべきなのか、何か式変形で抜けているものがあるのか、現状見つけられていません。lnKp を求める問題だったのでは…?という気もしているのですが…
一応正解が判断できる点 及び
本問を通じた学習項目として「ΔG = -RTlnK」、「ファントホッフの式」、「平衡定数 K と圧平衡定数 Kp の関係」を理解するには十分ということで、暫定的に公開しています。
わかる方いれば、参考文献と共にコメントいただければ幸いです。自身でも分かり次第、解説を更新する予定です。2024.09.02~
以上より、正解は 2 です。

コメント