問 題
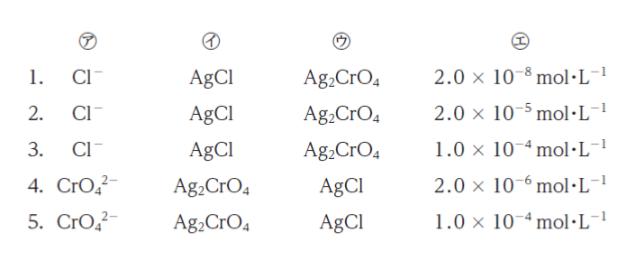
KCl を 1.0 × 10-3 mol、K2CrO4 を 1.0 × 10-3 mol 含む混合水溶液 1.0 mL がある。これに水を加え、全体を100 mL とした。これに、0.10 mol・L-1 の AgNO3 水溶液を一定温度の下で滴下した。このときの水溶液に関する次の記述の ㋐ ~ ㋓ に当てはまるものの組合せとして最も妥当なのはどれか。
ただし、この温度における AgCl,Ag2CrO4 の溶解度積はそれぞれ [Ag+][Cl–] = 2.0 × 10-10 mol2・L-2,[Ag+]2 [CrO42-] = 1.0 × 10-12 mol3・L-3 とする。また、滴下した AgNO3 水溶液の体積は無視できるものとする。
「この操作では先に ㋐ が ㋑ として沈殿し、その後 ㋒ が沈殿する。㋒ が沈殿し始めたとき、沈殿せず溶液中にイオンとして留まっている ㋐ の濃度は ㋓ である。」
解 説
溶解度積が与えられているので、溶解度を求めます。
【溶解度 S】
AgCl の溶解度を S1 とします。
AgCl ⇄ Ag+ + Cl– なので 溶解度積 Ksp = S12 です。2.0 × 10-10 = S12 を解けば、AgCl の溶解度は S1 = √2 × 10-5 と表せます。
一方、Ag2CrO4 の溶解度を S2 とします。
Ag2CrO4 ⇄ 2Ag+ + CrO42- なので 溶解度積 Ksp = (2S2)2(S2) = 4S23 です。1.0 × 10-12 = 4S23 を解けば、Ag2CrO4 の溶解度は S2 = 3√(1/4) × 10-4 です。
S1 < S2 なので
溶解度の小さい AgCl が先に沈殿します。 正解は 1 ~ 3 です。
【Ag2CrO4 が沈殿し始める時の [Ag+]】
Ag2CrO4 が沈殿し始める時の 銀イオンの濃度 [Ag+] は、[Ag+]2 [CrO42-] = 1.0 × 10-12 mol3・L-3 の [CrO42-] に 1.0 × 10-2 mol/L (※参照) を代入すれば、1.0 × 10-5 mol/L とわかります。
※ K2CrO4 を 1.0 × 10-3 mol 含んでいて、水を加え全体を 100 mL にしたので、もしこの水溶液が 1L あれば、その中には K2CrO4 を 1.0 × 10-2 mol 含むことになります。従って、濃度 1.0 × 10-2 mol/L です。
【溶けている [Cl–]】
[Ag+][Cl–] = 2.0 × 10-10 の [Ag+] に 1.0 × 10-5 mol/L を代入すれば、[Cl–] = 2.0 × 10-5 mol/L です。
以上より、正解は 2 です。

コメント