問 題
ヘンリーの法則によると、気体を溶質とする希薄溶液が気相と平衡にあるとき、気相における溶質の分圧 pB は、溶質のモル分率 xB = 溶質の物質量/溶液の物質量 に比例し、経験的に求められるヘンリー定数 KB を用いて次の式で表される。
pB = xB × KB
酸素と窒素が 1:4 で混合した 1.0 × 105 Pa の空気中で、1.0 kg の水に溶存している窒素の質量として最も妥当なのはどれか。
ただし、窒素の水への溶解にはヘンリーの法則が成り立つものとし、KB は 9.0 × 109 Pa、窒素及び水のモル質量はそれぞれ 28 g・mol-1、18 g・mol-1 とする。また、水の蒸気圧、窒素以外の物質の溶存は無視できるものとする。
1. 8.9 mg
2. 14 mg
3. 17 mg
4. 32 mg
5. 46 mg
解 説
・混合気体の分圧は、物質量の比なので、酸素と窒素が 1 : 4 、全圧が 1.0 × 105 Pa → 窒素の分圧は 0.8 × 105 Pa です。窒素に注目した時、問題文で与えられた式における「pB」が 0.8 × 105 Pa です。すると、KB も与えられているので、xB がわかりました。計算過程は以下のようになります。
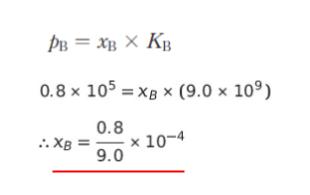
・問題文より、xB = 溶質の物質量/溶液の物質量 です。溶液は 1.0kg の水 なので、溶液の物質量は 1000/18 mol です。これで xB、溶液の物質量がわかったので「溶質 (窒素) の物質量」がわかります。単位を g に直すために さらに 28 をかければ、大体 14 mg とわかります。溶質の物質量を ? として、計算過程は以下の通りです。
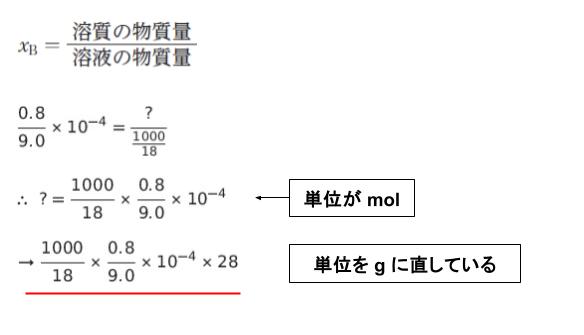
10-3 は「m (ミリ)」になおします。
すると、分子は 2240、分母が 162 なので、大体 14mg です。
以上より、正解は 2 です。

コメント