問 題
ホルムアルデヒド CH2O はメタノール CH3OH の気相接触空気酸化反応により製造されているが、生成した CH2O の一部は更に酸化されてギ酸 HCOOH になる。
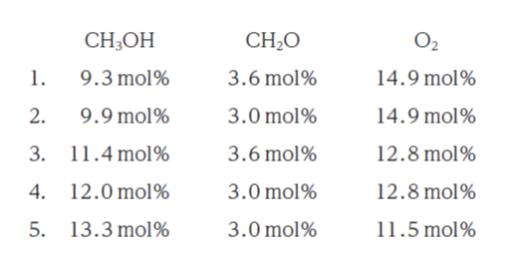
いま、反応器の出口ガスの mol% を調べたところ、HCOOH 0.6 mol%、H2O 3.6 mol%、N2 68.0 mol% であった。このときの反応器の出口における CH3OH、CH2O 及び O2 のmol% の組合せとして最も妥当なのはどれか。
ただし、空気は窒素と酸素がモル比で 4.0:1.0 の割合で混合された気体とし、反応器の出口では全ての物体は気体として存在するものとする。
解 説
本問に関連する化学式は以下のように表せます。
メタノールが酸化してホルムアルデヒドになる化学式
CH3OH + 1/2 O2 → CH2O + H2O…(1)
ホルムアルデヒドが酸化されてギ酸になる化学式
CH2O + 1/2 O2 → HCOOH…(2)
反応器の出口ガスの mol% のうち、問題文から
・HCOOH 0.6 mol%
・H2O 3.6 mol%
・N2 68.0 mol% とあり、合計:72.2 mol% 分の内訳は与えられています。残り 27.8 mol% 分の内訳を考える問題です。また、選択肢から CH3OH、CH2O、O2 の 3 種類の成分がわかればよいと読み取れます。
【CH2O:ホルムアルデヒド の mol%】
出口ガスにおいて H2O 3.6 mol% なので、式 (1) より、全く酸化されていなければ、出口においてホルムアルデヒドは 3.6 mol% です。
出口ガスにおいて HCOOH が 0.6 mol% なので、式 (2) より、酸化されたホルムアルデヒドは 0.6 mol% とわかります。
従って
出口ガスにおける ホルムアルデヒドは 3.6 – 0.6 = 3.0 です。正解は 2 or 4 or 5 です。
【O2 :酸素 の mol%】
出口ガスにおける N2 は、入ってきた空気由来です。空気における 窒素と酸素のモル比から、もしも全く消費されていなければ、出口において O2 が 68.0 × 1/4 = 17.0 mol% です。
式 (1) より、メタノールの酸化に 1.8 mol% 分使用されています。また、式 (2) より 0.3 mol% 分使用されています。合計 2.1 mol% 分、酸化に使用されているため、17.0 – 2.1 = 14.9 mol% です。選択肢 4,5 は誤りです。答えがわかったので、ここまででよいです。
以上より、正解は 2 です。

コメント