問 題
濃度不明の消毒液 (次亜塩素酸ナトリウム水溶液) がある。この消毒液の有効塩素濃度をヨウ素還元滴定法により ⑴、⑵、⑶ のように定量した。このとき、この消毒液の有効塩素濃度はおよそいくらか。
なお、このヨウ素還元滴定は、⑵ の操作により、① の反応でヨウ素が遊離し、⑶ の操作により、遊離したヨウ素が ② の反応で還元される性質を利用したものである。
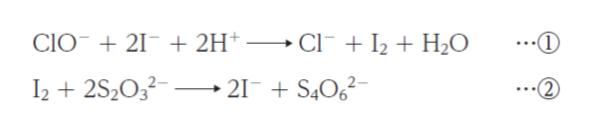
⑴ 濃度不明の消毒液 (次亜塩素酸ナトリウム水溶液) を正確に 5.0 mL 取り、精製水を加えて 100 mL とした。
⑵ ⑴ の溶液を正確に 30 mL 取り、ヨウ化カリウム 0.30 g と希硫酸 1.5 mL を加えて静かに振った。
⑶ ⑵の溶液を、希釈したデンプン溶液を指示薬として、濃度 9.3 × 10-2 mol・L-1 のチオ硫酸ナトリウム水溶液で滴定したところ、滴定量は 25 mL であった。
1. 1.3 × 10-1 mol・L-1
2. 3.9 × 10-1 mol・L-1
3. 4.4 × 10-1 mol・L-1
4. 7.8 × 10-1 mol・L-1
5. 8.4 × 10-1 mol・L-1
解 説
濃度不明の消毒液の濃度を x (mol/L) とします。
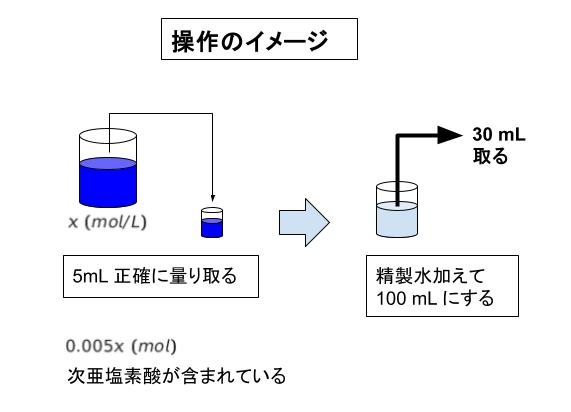
(1) の操作前半により 量り取った 5.0 mL 中に 0.005 x (mol) 次亜塩素酸が含まれています。精製水で 100mL としていますが、この時 入っている mol に変化はありません。
(2) では、(1) の溶液を 30mL 取っているため、この中には 「(0.005 x) × 30/100」mol…(1) 次亜塩素酸が含まれます。ここまでのイメージが以下図です。
化学反応式 ① の左辺 ClO– と I2 の係数が共に 1 で等しいので、次亜塩素酸の mol がそのままヨウ素の物質量です。そして、化学反応式 ② の左辺 I2 と左辺 S2O32- の係数比が 1:2 なので、ヨウ素の物質量の 2 倍、チオ硫酸ナトリウムが反応すると読み取れます。
チオ硫酸ナトリウムは 濃度 9.3 × 10-2 mol/L、滴定量が 25 mL = 0.025 L なので、その中に含まれるチオ硫酸ナトリウムの物質量は (9.3 × 10-2) × 0.025 mol…(2) です。
(2) の半分がヨウ素の物質量であり、次亜塩素酸の物質量なので、(1) × 2 = (2) が成り立ちます。
つまり
(0.005 x) × 30/100 × 2 = (9.3 × 10-2) × 0.025 です。
方程式を解くと x ≒ 7.8 × 10-1 を得ます。
以上より、正解は 4 です。

コメント