問 題
原子軌道とそのエネルギーに関する次の記述の ㋐、㋑ に当てはまるものの組合せとして最も妥当なのはどれか。
「シュレーディンガー方程式を解いて得られる水素原子の主量子数 n=3、方位量子数 l =1 の軌道のエネルギー E3.1 と n = 3、l = 2 の軌道のエネルギー E3.2 との間には、 ㋐ の関係が成り立つ。水素原子の考えを多電子系へ拡張することによって多電子原子の電子状態も考えることができる。
例えば、炭素原子の 6 個の電子は、n = 1 の原子軌道に 2 個、n = 2 の原子軌道に 4 個入る。炭素原子の n = 2、l = 0 の軌道のエネルギー E2.0 と n = 2、l = 1 の軌道のエネルギーE2.1 との間には、 ㋑ の関係が成り立つ。」
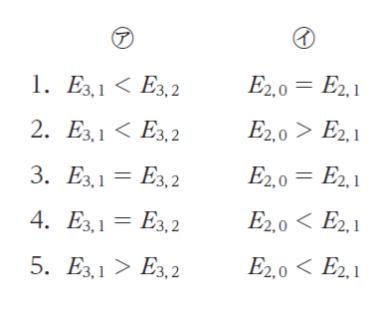
正解.4
解 説
水素原子、つまり電子 1 個の範囲では、主量子数が同じならば エネルギーは同じです。従って、E3.1 = E3.2 です。正解は 3 or 4 です。
n = 2、l = 0 とは 2s 軌道、n = 2、l = 1 とは 2p 軌道です。多電子系において、エネルギーが低い順に 2s、2p なので E2.0 < E2.1 です。
以上より、正解は 4 です。

コメント