問 題
クラウジウス-クラペイロンの式は、次のとおり定義される。
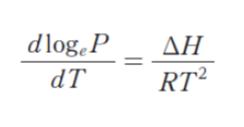
ここで、P は圧力、T は熱力学温度、ΔH はモル蒸発エンタルピー、R は気体定数である。1 気圧 (101 kPa) において、室温 (298 K) で液体である有機化合物 A の沸点は 350 K、沸点における ΔH は 30 kJ・mol-1 である。A の 300 K における蒸気圧はおよそいくらか。
ただし、A はクラウジウス-クラペイロンの式に従い、ΔH は温度によらず一定であるものとする。また、R を 8.3 J・K-1・mol-1、自然対数の底 e を 2.7 とする。
1. 0.1 kPa
2. 2 kPa
3. 6 kPa
4. 18 kPa
5. 54 kPa
解 説
沸点 350K であれば蒸気圧 = 大気圧です。温度 300K では蒸気圧がいくらか、という問題です。クラジウスークラペイロンの式の 微分形が与えられているので、積分します。
不定積分の結果が
lnP = (ΔH/R) ・ (-1/T) です。
T:300K → 350K、P:P → p0 なので
定積分により
lnP ー lnP0 = {(ΔH/R)・(1/350 – 1/300)} となります。
左辺を 対数の差の公式から ln(P/P0) とします。
対数の定義:ea = b の時、a = lnb より式を 変形すると
P/P0 = e{ΔH/R (1/350 – 1/300)} となおせるため、両辺に P0 をかけて
P = P0 × e{ΔH/R (1/350 – 1/300)} です。
P0 = 101、ΔH = 30000、R = 8.3 を代入して、一例として以下のように計算すると 大体 14 よりやや大きい数 と評価できます。

選択肢から最も近い数を選べば、18k です。
以上より、正解は 4 です。

コメント