問 題
あらかじめ真空にした容器に、CH4 と O2 を物質量比 1:3 で混合した気体を封入した。この気体の温度を 300 K にしたところ、容器内の圧力は 1.00 × 105 Pa となった。その後、CH4 を完全燃焼させ、温度が 300 K に戻るまで冷却したところ、液体の水が生成した。このときの容器内の圧力として最も妥当なのはどれか。
ただし、気体は全て理想気体として扱い、液体の水への気体の溶解は無視できるものとする。また、300 K における飽和水蒸気圧は 3.57 × 103 Pa であり、容器の容積は変化せず、液体の水の体積は無視できるものとする。
1. 2.5 × 104 Pa
2. 2.9 × 104 Pa
3. 4.6 × 104 Pa
4. 5.0 × 104 Pa
5. 5.4 × 104 Pa
解 説
【完全燃焼前】
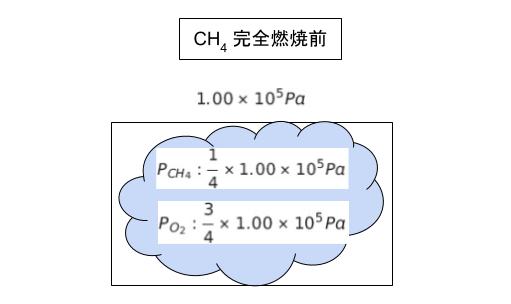
混合気体において、それぞれの気体の分圧は物質量の比になります。完全燃焼する前の状態において、CH4 の分圧 PCH4 は (1/4) × (1.00 × 105) Pa、O2 の分圧 PO2 は (3/4) × (1.00 × 105) Pa です。
【完全燃焼後】
CH4 の完全燃焼の式は
CH4 + 2O2 → CO2 + 2H2O です。
係数を見れば、CH4 は同じ物質量の CO2 になるので、分圧に変化ありません。また、O2 が CH4 の 2 倍消費されるので、O2 の分圧は (1/4) × (1.00 × 105) になるとわかります。H2O に関しては液体の水が生成したので、飽和水溶液圧 3.57 × 103 Pa が気体の水の分圧です。
× 104 で揃えると
PCO2:2.5 × 104
PO2:2.5 × 104
PH2O:0.357 × 104 です。
従って、容器内の圧力は「PCO2 + PO2 + PH2O」
= (2.5 × 104) + (2.5 × 104) + (0.357 × 104)
≒ 5.4 × 104 です。
以上より、正解は 5 です。

コメント