問 題
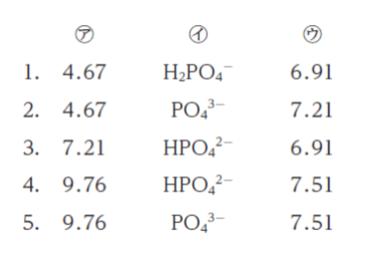
次の記述の ㋐、㋑、㋒ に当てはまるものの組合せとして最も妥当なのはどれか。
ただし、リン酸の第一解離の pKa1 = 2.12、第二解離の pKa2 = 7.21、第三解離の pKa3 = 12.3とし、log102 = 0.301、log103 = 0.477 とする。
・ 0.100 mol/L リン酸水溶液 100 mL に、0.100 mol/L 水酸化ナトリウム水溶液 200 mL を加えた溶液の pH は ㋐ である。この溶液中に存在している主なイオン種は ㋑ である。
・ 0.200 mol/L リン酸二水素一ナトリウム水溶液 200 mL に、0.100 mol/L リン酸一水素二ナトリウム水溶液 800 mL を加えた溶液のpH は ㋒ である。
解 説
【㋐、㋑】
㋐、㋑ ですが
H3PO4 + NaOH →NaH2PO4 +H2O … ①
NaH2PO4 + NaOH → Na2HPO4 +H2O… ②
Na2HPO4 + NaOH → Na3PO4 +H2O… ③
と段階的に中和がおきると考えられます。
0.1 mol/L リン酸水溶液 100mL には 0.01 mol リン酸があります。0.1 mol/L NaOH 200 mL には 0.02 mol NaOH があるので ② まで完全に進行すると考えられます。
② の反応の進行途中において
[H2PO4–] と [HPO42-] が 1:1となる pH が、第二解離の pKa2 = 7.21 です。つまり、NaOH を 150 mL 入れた時に pH が 7.21 となり、それよりも NaOH を加えているとわかります。すると、pH は 7.21 よりも大きいと判断できます。選択肢から選べば ㋐ は 9.76 です。
NaOH 200 mL を加えると、Na2HPO4 が主に存在しています。イオン種としては「HPO42-」がメインと考えられます。㋑ は「HPO42-」です。これで ㋒ は 7.51 とわかります。
【㋒ 補足】
㋒ に関して
NaH2PO3 0.04 mol と Na2HPO3 0.08 mol を加えています。全体の体積は 200 mL + 800 mL = 1000 mL = 1L となっています。
② 式の pKa = 7.21
ヘンダーソン・ハッセルバルヒの式より
pH = pKa + log[A-]/[HA]
[HA] に対応する方として [H2PO3–] = 0.04 mol/L
[A-] に対応する方として [HPO32-] = 0.08 mol/L を代入して
pH = 7.21 + log(0.08/0.04)
= 7.21 + 0.301
≒ 7.51 となります。
以上より、正解は 4 です。
類題 薬剤師国家試験 105 回 問96
https://yaku-tik.com/yakugaku/105-096/

コメント