問 題
ある熱分解炉にエタンを 1890 kg・h-1 で連続供給し、次の反応でエチレンを製造する。
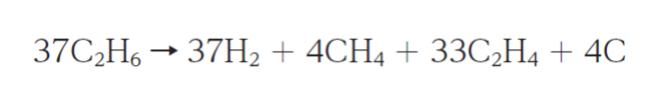
定常状態になっているとき、熱分解後の出口ガスの組成は、モル分率で H2 が 0.370、CH4 が 0.040、C2H4 が 0.330、C2H6 が 0.260 であった。C (グラファイト) は固体のため、出口ガス組成のモル分率には含まれないが、出口物質としては存在している。
単位時間当たりに製造されるエチレンの質量として最も妥当なのはどれか。ただし、C とH の原子量をそれぞれ 12.0、1.0 とする。
1.780 kg・h-1
2.924 kg・h-1
3.990 kg・h-1
4.1180 kg・h-1
5.1570 kg・h-1
解 説
1890 kg・h-1 は「1 時間に 1890 kg」です。kg を mol になおすと、1890 ÷ 30 = 63 mol となります。つまり、エタンは 63 mol/h 連続供給されています。出口ガスにエタンが残っているので、供給される 63 mol/h のうち、x mol/h エタンが反応するとします。
反応式の左辺の係数は 37 です。一方、右辺について、固体として出口に存在する C を除く係数の和が 37 + 4 + 33 = 74 です。係数比が 1:2 となるので、x mol 反応すれば、2x mol 気体が生成されます。x mol/h 反応すれば、2x mol/h 出口ガスが生成されるということです。
この時、出口ガスには未反応のエタンも供給されるため、全体としては「2x + (63 -x) mol」が出口ガスとして存在します。
出口ガスにおける エタンの割合が 0.26 であることから
(63 – x)/{2x + (63 -x)} = 0.26 となります。
この方程式を問題文から立てるのが、本問のポイントです。
方程式を解くと
x = 37 とわかります。
37 mol/h エタンが反応しているので
33 mol/h エチレンが生成します。
mol を kg に直すと
33 × 28 = 924 kg となります。これが、単位時間当たりに製造されるエチレンの質量です。
以上より、正解は 2 です。

コメント