問 題
A から B が生成する反応は、次の反応式で表され、A についての一次反応である。
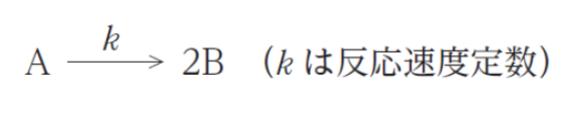
この反応を等温回分反応器を用いて、次の条件で行い、B を 1 時間当たり 3.0 × 104 mol 生成したい。

このとき、必要な反応器の体積はおよそいくらか。ただし、loge 0.2 = -1.6 とする。
1. 1.4 m3
2. 2.8 m3
3. 3.1 m3
4. 5.6 m3
5. 6.2 m3
解 説
一次反応なので、半減期 T1/2 = ln2/k です。※ ln2 ≒ 0.7 も含め、基礎知識です。問われているのが 1 時間あたりなので、3600 をかけて k の単位を時間あたりに直すと、 k = 1.0 × 10-4 /s → 0.36 /h です。半減期は 0.7/0.36 ≒ 2 時間とわかります。
反応器の体積が仮に 1m3 とすると、条件より A の濃度が 3.0 × 104 なので、A が 3.0 × 104 mol 存在します。
反応率 80% にいたるのは、大体 「2 半減期」過ぎたころです。つまり大体 4 時間後です。前処理と後処理の 30 分 × 2 を考慮すれば「計 5 時間」反応にかかります。
できあがる B の量は 反応式から「A の 80% × 2」です。5 時間かけて 4.8 × 104 mol 生成なので、1 時間あたり ほぼ 1 × 104 mol 生成です。
1 時間あたり B を「3 × 104」mol ほしいので、必要な体積は 3 倍です。最も近い値を選択肢から選べば 3.1 m3 です。
以上より、正解は 3 です。
ちなみに、loge0.2 = -1.6 は
[A] = [0.2A] になる時の時間 t を正確に求める場合に用います。
一次反応なので
[A] = [A0]e-kt です。ここで [A] = [0.2A] を代入し、両辺 ln 取った時に用いるヒントです。
参考 微分型速度式の積分型速度式への変換
https://yaku-tik.com/yakugaku/bk-4-1-2/

コメント