問 題
25 ℃ において、水 0.1 L に一定量の一価の弱電解質の薬物結晶を加えた。pH を変化させて溶解平衡に達したとき、pH 5 から pH 8 における溶液中の薬物の総濃度と分子形薬物濃度がグラフのようになった。
以下の記述のうち、正しいのはどれか。2 つ選べ。
ただし、薬物の分子形とイオン形の溶解平衡時の濃度比は Henderson – Hasselbalch の式に従い、薬物の溶解や pH 調整に伴う容積変化は無視できるものとする。
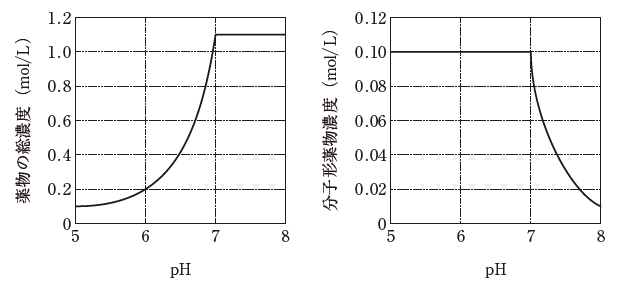
- 用いた薬物は 1.1 mol である。
- 薬物は弱酸性化合物である。
- 薬物の pKa は 5 である。
- pH 7 のとき、薬物の分子形濃度とイオン形濃度の比は 1:10 である。
- pH 8 のとき、薬物の結晶が液中に存在する。
解 説
溶解平衡とは、固体とその飽和溶液が共存し、固相と液相が平衡にある状態のことです。この時、溶液の濃度を溶解度と呼びます。言い換えると、溶解平衡だったら、溶液に溶けるだけ溶かしきった最高に濃い液+固体 の話となります。
薬物の総濃度の所を見ると、pH をあげればあげるほど、どんどん固体から溶け出していっているのが読み取れます。そして、pH = 7 以降は、ピタッと止まっている、ということは「pH = 7 で溶けきった」と考えます。
pH をあげていく、つまり、塩基性にしていくほど溶けていったのであれば、薬物はきっと、「HX」といった化学式で表される、弱酸性化合物と推測できます。以上をふまえ、選択肢を検討します。
選択肢 1 ですが
全て溶けた pH = 7 以降に注目します。水 0.1 L で、薬物総濃度が 1.1 mol/L と読み取れます。従って、用いた薬物は 1.1 mol/L × 0.1 L = 0.11 mol です。1.1 mol ではありません。選択肢 1 は誤りです。
選択肢 2 は妥当です。
選択肢 3 ですが
pKa とは、分子形とイオン形が 1:1 になるような pH です。分子形濃度が 0.10、イオン形濃度が 0.10、薬物の総濃度 0.2 となるような pH = 6 が、pKa と読み取れます。pKa は 5 ではありません。選択肢 3 は誤りです。
選択肢 4 は妥当です。
選択肢 5 ですが
pH = 7 で結晶は溶け切っており、pH が 7 より大きい場合には、もう新たに溶ける固体結晶部分が存在しないため、薬物の総濃度が上昇していないと考えられます。従って、pH = 8 の時、薬物の結晶は存在しません。選択肢 5 は誤りです。
以上より、正解は 2,4 です。

コメント