問 題
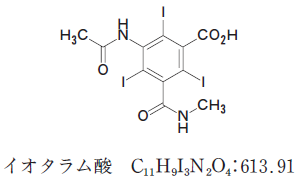
次の記述は日本薬局方イオタラム酸の定量法に関するものである。
「本品を乾燥し、その約0.4gを精密に量り、けん化フラスコに入れ、水酸化ナトリウム試液40mLに溶かし、亜鉛粉末1gを加え、還流冷却器を付けて30分間煮沸し、冷後、ろ過する。フラスコ及びろ紙を水50mLで洗い、洗液は先のろ液に合わせる。
この液に酢酸(100) 5mLを加え、0.1mol/L硝酸銀液で滴定する(指示薬:テトラブロモフェノールフタレインエチルエステル試液1mL)。ただし、滴定の終点は沈殿の黄色が緑色に変わるときとする。」
本品0.4500gをとり、上記の定量法に従って、0.1mol/L硝酸銀液(f=1.000)で滴定したところ、18.00mLを消費した。このときイオタラム酸の含量%に最も近い数値を1つ選べ。
- 75.0
- 81.9
- 88.8
- 95.5
- 99.5
正解.2
解 説
構造から、I(ヨウ素) が3つあること に注目します。1mol イオタラム酸があれば、3mol 硝酸銀が反応するんだろうと考えます。
滴定で使った硝酸銀は 18mL だから、0.0018 mol です。これは、イオタラム酸が 0.0006 mol ということです。イオタラム酸は、1mol で 約 614g と、分子量からわかります。0.0006 mol だと、だいたい 0.37g です。測ったのが、0.45g だったから、このうち 約 80 % より少し上が、含量です。
以上より、正解は 2 です。

コメント