問 題
ヒトの体液は主に炭酸と炭酸水素イオンの濃度バランスによりpH7.4に維持されている。pH7.3のアシドーシスを起こした患者の体液中のHCO3–/H2CO3の存在比に最も近い値はどれか。1つ選べ。
ただし、炭酸は次式のように解離し、その2つのpKaは、それぞれpKa1=6.1、pKa2=10.5とする。またlog101.6=0.2とする。
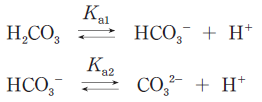
- 1.6
- 2.0
- 8.3
- 16
- 20
解 説
Ka1 = [HCO3–][H+]/[H2CO3] という式について、両辺の log10 をとると
log10Ka1 = log10([HCO3–][H+]/[H2CO3])
ここで、pH や pKa の接頭語「p」は「-log10」の略であることから、左辺を -pKa1 と表します。さらに、右辺は対数の公式から、掛け算を足し算にできるので
-pKa1 = log10[HCO3–]/[H2CO3] + log10[H+] と変形します。こうすることで、求めたい HCO3–/H2CO3 が右辺の第一項に出てきます。ここで更に pH = -log10[H+] なので、log10[H+]を、-pH と表せば
-pKa1 = log10[HCO3–]/[H2CO3] -pH です。問題文の数値を代入すると
-6.1 = log10[HCO3–]/[H2CO3] -7.3
∴ log10[HCO3–]/[H2CO3] = 1.2
logab = c の場合、ac = b だから、求めたい[HCO3–]/[H2CO3] は、101.2 とわかります。101.2 = 101 × 100.2 です。問題文に与えられた log101.6 = 0.2 ということから、100.2 = 1.6 です。従って、101.2 = 101 × 1.6 = 16となります。
以上より、正解は 4 です。

コメント