問 題
金属MとそのイオンMn+からなる半電池の標準電極電位E°に関する記述のうち、正しいのはどれか。2つ選べ。
- E°は、金(Au)の半電池を基準とした相対値として測定される。
- E°は、イオンMn+の活量が1のときの値である。
- E°は、負の値をとらない。
- E°は、温度に依存せず一定である。
- E°が正の大きな値であるほど、
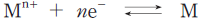 の反応は右に進みやすい。
の反応は右に進みやすい。
正解.2, 5
解 説
選択肢 1 ですが
標準電極電位は、水素が基準です。よって、選択肢 1 は誤りです。
選択肢 2 は、正しい選択肢です。
ちなみに、イオンの活量 とは理想溶液と現実の溶液のズレを補正するためのパラメータです。
選択肢 3 ですが
標準電極電位は、イオン化傾向を数値化したようなものと考えるとわかりやすいです。真ん中を H とおいており、それよりもイオン化傾向が大きい場合は 負、イオン化傾向が小さい場合は正 です。 負の値をとります。よって、選択肢 3 は誤りです。
選択肢 4 ですが
温度に依存します。これは、標準電極電位が、イオン化傾向の数値化のようなものと考えると推測できるのではないかと思います。
すなわち、温度が高ければ、普通ならイオンになりにくい物質もエネルギーが高く、イオンになりうると考えれば、同じ元素であっても、温度によってイオン化傾向が変化するといえます。そして、温度によりイオン化傾向が同じ元素であっても変わるのであれば、温度により標準電極電位も変化する、といえるはずと考えられます。よって、選択肢 4 は誤りです。
選択肢 5 ですが
正の大きな値をとるものとして、Pt や Au を考えるとよいと思います。これはできるだけ金属単体であろうとする元素なので反応は右に進みやすいといえます。
以上より、正解は 2,5 です。

コメント