問 題
日本薬局方フェニレフリン塩酸塩の定量法に関する記述のうち、正しいのはどれか。2つ選べ。
本品を乾燥し、その約0.1gを精密に量り、ヨウ素瓶に入れ、水40mLに溶かし、0.05mol/L臭素液50mLを正確に加える。更に塩酸5mLを加えて直ちに密栓し、振り混ぜた後、15分間放置する。
次にヨウ化カリウム試液10mLを注意して加え、直ちに密栓してよく振り混ぜた後、5分間放置し、遊離したヨウ素を0.1mol/Lチオ硫酸ナトリウム液で滴定する(指示薬:デンプン試液1mL)。
同様の方法で空試験を行う。
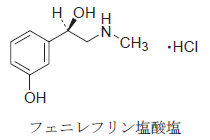
- 本品1モルに対して、3モルの臭素が反応する。
- 臭素1モルに対して、3モルのヨウ化カリウムが反応する。
- ヨウ素1モルに対して、1モルのチオ硫酸ナトリウムが反応する。
- チオ硫酸ナトリウム液による滴定は、中和滴定である。
- チオ硫酸ナトリウム液の滴定量は、空試験の方が多くなる。
解 説
定量問題は、とっかかりにくい問題ではないかと思います。勉強する時に、少し楽になったポイントは、実験的に大雑把な記述を読み飛ばすことでした。
この問題を例に上げると、「精密に」とか、濃度も含めて書いてある試薬にのみ注目するということです。つまり、水、塩酸に関しては気にしません。ヨウ化カリウムは注意してとあるので、考慮に入れます。
すると、結局の所「フェニレフリン + 臭素」→「ヨウ化カリウムを加える」→「ヨウ素が遊離する」→「遊離したヨウ素を、チオ硫酸ナトリウムで滴定」という実験になります。
ここで、臭素とヨウ化カリウムで、ヨウ素が遊離するのは以下の化学式を考えると納得がいくのではないかと思います。すなわち、Br2 + 2KI → 2KBr + I2 です。よって、臭素 1 モルに対して反応するのは 2 モルのヨウ化カリウムであるため、選択肢 2 は誤りです。
又、この実験では、最初にフェニレフリンと臭素が反応すると考えられます。すなわち、存在する薬(フェニレフリン)の量だけ、臭素が少なくなりその分遊離するヨウ素が減るため、ヨウ素を滴定することで間接的にフェニレフリンの量がわかると考えられます。
さて、フェニレフリンと臭素の反応ですが、フェニレフリンの主要な官能基は、名前も含めて考えるとフェノールではないかと推測されるのではないでしょうか。
すると、フェノールと臭素といえば 2,4,6-トリブロモフェノールが生じると考えられます。つまり、本品 1 モルに対し、臭素 3 モルが反応します。
以上より、正解は 1、5 です。
ちなみに、ヨウ素とチオ硫酸ナトリウムの反応は、以下の式で表される酸化還元反応です。
2S2O32ー + I2ー → S4O62ー + 2Iー
式の係数に注目すれば、選択肢 3 は誤りです。又、中和反応ではないため、選択肢 4 は誤りです。この式は国家試験で頻出なので、見慣れておくとよいかと思います。

コメント