問 題
厚生康太 (こうせい こうた) 氏、75 歳男性。身長 170 cm、体重 65 kg。一過性脳虚血発作で入院し、再発予防目的でプラビックス錠(注) 25 mg が 1 回 2 錠、1 日 1 回の処方で服薬開始となった。
2023 年 7 月 1 日に起床時のふらつきと意識障害をきたし、近医へ救急搬送され、緊急入院となった。入院時の血糖値 33 mg/dL、入院翌日の空腹時血糖値 14 mg/dL、血中インスリン濃度 127.5 μIU/mL (基準値 2.7 ~ 10.4) であった。プラビックス錠は入院直後に中止された。
検査の結果、患者はプラビックス錠の副作用であるインスリン自己免疫症候群と診断された。入院 7 日後には検査所見、自覚症状ともに改善した。
薬剤師は医薬品・医療機器等安全性情報報告制度に基づき、医薬品安全性情報報告書を作成するとともに、実務実習中の薬学部学生にも報告書の作成の練習をしてもらうこととした。
(注) プラビックス錠:クロピドグレル硫酸塩錠
問306
本報告制度に基づく報告を行うことは、医薬品の安全対策を講じていくために重要である。副作用の報告に関する記述のうち、正しいのはどれか。2 つ選べ。
- 薬剤師は、製造販売業者が行う副作用情報の収集に協力するよう努めなければならない。
- 薬剤師は、本報告制度により、知り得た副作用はすべて報告しなければならない。
- 薬剤師は、本報告制度による報告を行う場合、患者の同意を得なければならない。
- 製造販売業者は、自社が関与していない医薬品に関する副作用の情報を入手した場合も報告しなければならない。
- 患者が自身の副作用を疑った場合、患者自ら独立行政法人医薬品医療機器総合機構 (PMDA) に報告することができる。
問307
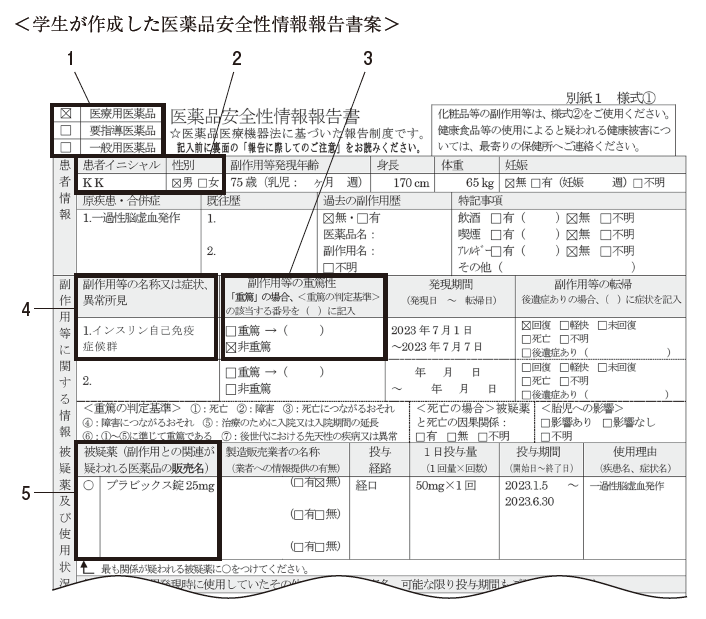
薬学部学生がこの患者のインスリン自己免疫症候群について作成した、下図の医薬品安全性情報報告書案を指導薬剤師が確認したところ、不適切な記載を 1 ケ所発見した。それはどれか。1 つ選べ。
正解.
問306:1, 5
問307:3
解 説
問306
選択肢 1 は妥当です。
薬機法により、製造販売業者の情報収集に協力するよう努めなければなりません。
選択肢 2 ですが
報告対象となる情報は、保健衛生上の危害の発生又は拡大を防止する観点から報告の必要があると判断した情報です。「知り得た副作用はすべて」ではありません。選択肢 2 は誤りです。
選択肢 3 ですが
「法令に基づく場合」として、患者の同意を得ずに報告可能です。「患者の同意を得なければならない」わけではありません。選択肢 3 は誤りです。
選択肢 4 ですが
自社が関与していない医薬品について報告義務はありません。選択肢 4 は誤りです。
選択肢 5 は妥当です。
患者副作用報告と呼ばれます。
以上より、問 306 の正解は 1,5 です。
問307
重篤とは、患者さんに発現した事象によって引き起こされた死亡、入院、障害、先天異常といった結果に対する外形的な評価です。本症例では、緊急入院しているので、副作用等の重篤性は「重篤」です。非重篤ではありません。
以上より、問 307 の正解は 3 です。

コメント