問 題
プリオン病では、プリオンタンパク質 (PrP) の感染性を有した異常型が蓄積する。プリオンタンパク質の特徴として、正常型である PrPc と異常型である PrPSc が相互作用 (会合) すると、正常型が異常型へと変換されることが知られている。
図 1 は NMR により解析された PrPc の立体構造、図 2 は PrPSc の仮想の立体構造をそれぞれ安定な二次構造をわかりやすくリボン図で描いている。なお、図中には示されていないが、PrPc の C 末端には GPI アンカーが付加されている。
図3は、PrP の遺伝子配列から予想される翻訳産物をアミノ酸の一文字表記で示している。アミノ酸配列のうち、プロリン残基は黒点 (●) で、グリシン残基は 2 重下線で示している。
以下の記述のうち、正しいのはどれか。2 つ選べ。
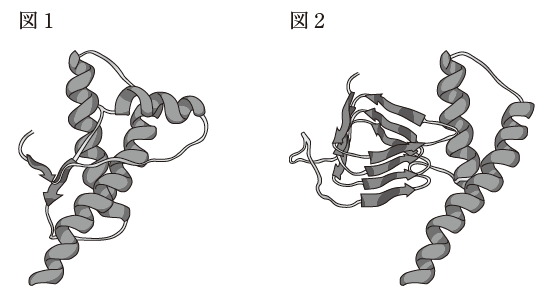

- 図 2 に示す PrPSc は、図 1 に示す PrPc に比べて β シート構造が多い。
- β シート構造の安定性は、並行するペプチド鎖間で形成されるジスルフィド (S-S) 結合によっている。
- 図 3 に示す PrP に点在するプロリンは、その環状構造により二次構造の形成とその規則性に影響を与えている。
- 図 3 に示す PrP に多く存在するグリシンは、特定の二次構造からループ構造への変化を妨げる要因となっている。
- PrPc において GPI アンカーが結合するアミノ酸残基は、図 3 で 1 番目のメチオニンである。
解 説
選択肢 1 は妥当です。
β シート構造は、図における 「→」 で表されている部分構造です。図 2 の方が多く見られます。
選択肢 2 ですが
β シート構造の安定性は、並行するペプチド鎖間で形成される「水素結合」によっています。「ジスルフィド (S – S) 結合」ではありません。ちなみにですが、α ー ヘリックス構造の安定性も、水素結合由来です。選択肢 2 は誤りです。
選択肢 3 は妥当です。
ちなみにですがプロリンは、グリシンと共に二次構造に影響を与える「二次構造ブレイカー」と呼ばれることがあります。
選択肢 4 ですが
グリシンは分子量が小さいアミノ酸なので、小回りがきいた構造を作りやすいのではないかと推測できるのではないでしょうか。グリシンは二次構造ブレイカーの 1 つとして知られており、二次構造 → ループ構造を 促進する要因とされています。「二次構造からループ構造…変化を妨げる要因」ではないと考えられます。選択肢 4 は誤りです。
選択肢 5 ですが
GPI アンカーとは、細胞表面に存在する、タンパク質を細胞膜につなぎ止める錨 (アンカー) の役割を担う「糖脂質」です。GPI は「グリコシル ホスファチジル イノシトール:glycosyl phosphatidyl inositol」の略です。
GPI アンカーは、その構成要素である「3 つ存在するエタノールアミンリン酸のうち 1 つ」が、「タンパク質のカルボキシル基側 (つまり、問題文にもあるように “C 末端” )」とアミド結合します。
そして、アミノ酸配列表は N 末端から C 末端に向けて、左から右に記載します。従って、図 3 における253 番目の G:グリシン と GPI アンカーが結合すると考えられます。選択肢 5 は誤りです。
以上より、正解は 1,3 です。
ちなみに
GPI アンカーとつながる GPI アンカータンパク質の欠損は、指定難病の 1 つ「発作性夜間ヘモグロビン尿症 PNH:paroxysmal nocturnal hemoglobinuria」の病態の本質です。

コメント