問 題
25 ℃ における 0.01 mol/L 安息香酸水溶液の pH に最も近い値はどれか。1 つ選べ。ただし、安息香酸の pKa = 4.2 (25℃) とする。
- 1.5
- 3.0
- 4.5
- 6.0
- 7.5
正解.2
解 説
『弱酸 HA の電離による pH ときたら、まず水素イオン濃度[H+]=√(Ka・C)』を公式として覚えておき、思い出すことができれば計算できたと思われます。ただ、対数におけるルート部分の処理が必要なので、少し難しく感じたかもしれません。
[H+]=√(Ka・C)の両辺 ーlog10 をとることで、左辺は pH です。右辺について、ーlog10 をとった後、以下のように計算できて、3.1 が出てきます。※問題文より C = 0.01 = 10-2 です。
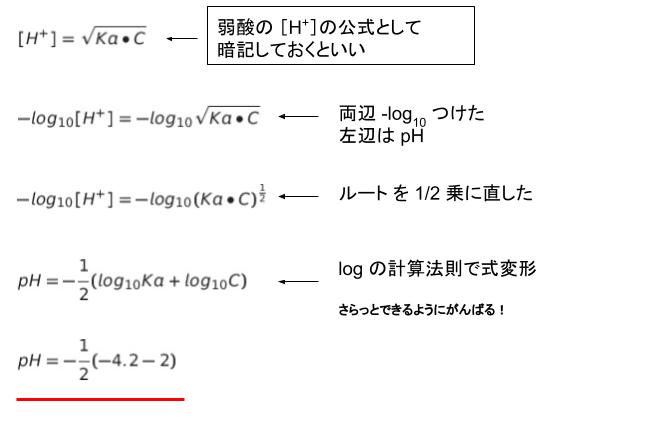
最も近い値は 3.0 です。
以上より、正解は 2 です。

コメント